Os alcenos são hidrocarbonetos insaturados que, como os alcanos, formam uma série homóloga. No entanto, ao contrário dos alcanos, os alcenos têm uma ligação múltipla – uma ligação dupla – entre os átomos de carbono. Os restantes são ligações simples, mas a ocorrência de até mesmo uma ligação múltipla em uma molécula torna o hidrocarboneto um composto insaturado.

A estrutura dos alcenos
A ligação CC entre átomos em hidrocarbonetos saturados faz com que cada um deles tenha uma hibridação sp 3 . Nos alcenos, que possuem ligações C=C, ocorre uma hibridização sp 2 . Essa propriedade faz com que a estrutura dos compostos com ligações duplas seja uma forma trigonal. Suas 3 ligações sigma estão no mesmo plano e estão voltadas para os vértices do triângulo equilátero, cujo centro é o átomo de carbono. Em contraste, as ligações pi resultam da sobreposição de um orbital p não híbrido em uma direção perpendicular ao triângulo, que é formado por orbitais híbridos e orbitais de simetria semelhante do átomo vizinho. A construção mais simples do grupo, e o primeiro composto da série homóloga do alceno, é o eteno. O metano, um composto que é o primeiro dos alcanos, não poderia formar uma ligação múltipla.
Um exemplo da estrutura do alceno
Vamos pegar o composto mais simples do grupo, o eteno, e examinar sua estrutura. Sabemos que os átomos de carbono na molécula de eteno têm uma hibridização sp 2 , portanto a molécula é plana. Os ângulos entre as ligações neste layout são de 120 o . As quatro ligações entre os átomos de carbono e hidrogênio presentes na estrutura CH são ligações sigma δ SP-s com sobreposição frontal. Existem também ligações homonucleares formadas entre os átomos de carbono. Um é CC δ sp-sp e o outro é CC π pp , que é formado por orbitais p não híbridos.
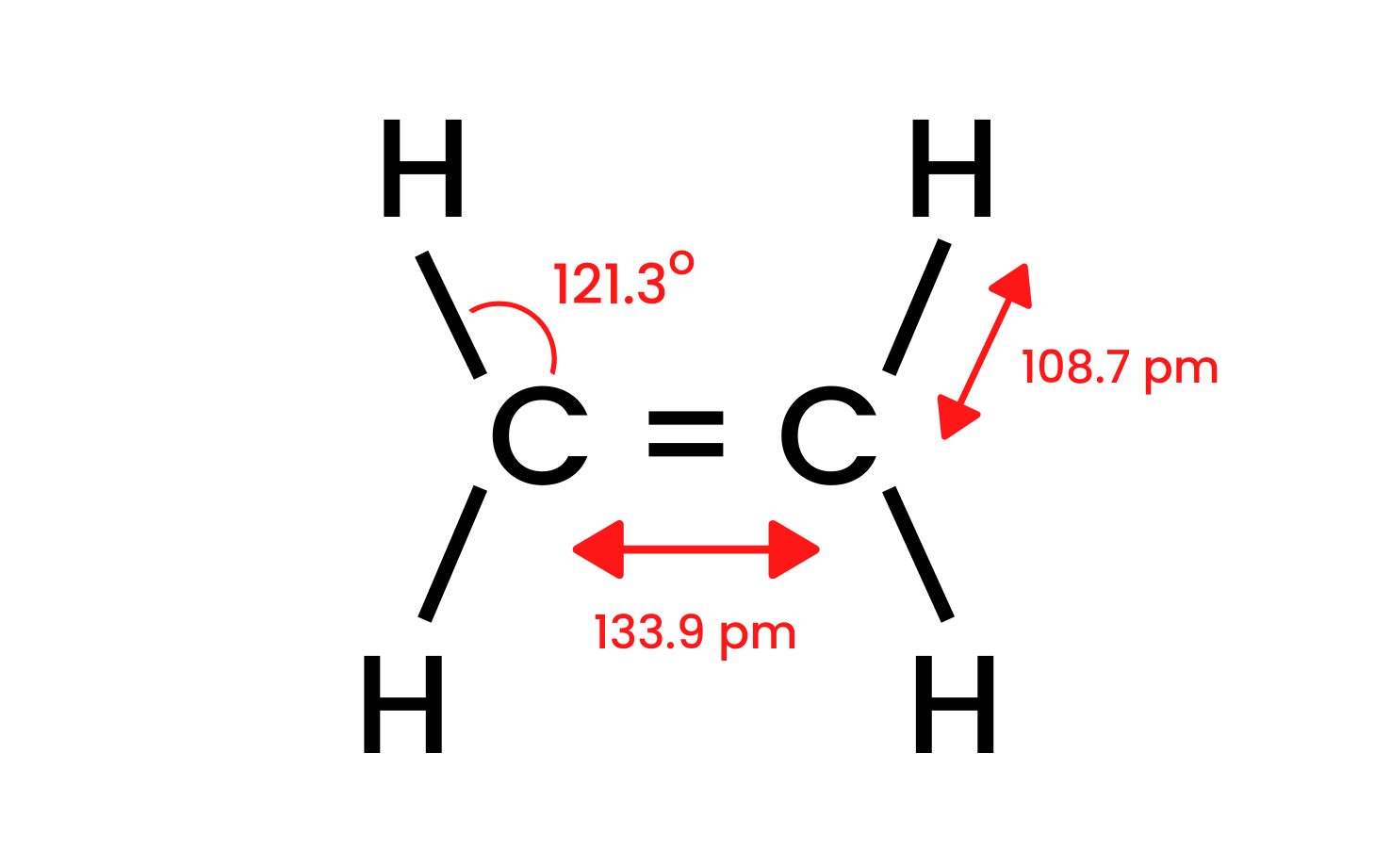
Figura 1. A estrutura do eteno
Série homóloga de alceno
Uma série homóloga é um grupo de compostos químicos que possuem estrutura e propriedades químicas muito semelhantes. Essas substâncias também podem ser escritas com uma fórmula molecular comum. A fórmula geral para alcenos pode ser escrita como C n H 2n . Estruturalmente, é assim:
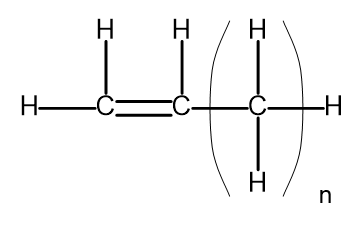
Figura 2. Fórmula estrutural geral para alcenos
| Número de átomos de carbono na cadeia | fórmula de alcano | Nome do alcano | fórmula de alceno | nome do alceno |
| 2 | C 2 H 6 | Etano | C 2 H 4 | Eteno |
| 3 | C 3 H 8 | Propano | C 3 H 6 | Propeno |
| 4 | C 4 H 10 | butano | C 4 H 8 | buteno |
| 5 | C 5 H 12 | pentano | C 5 H 10 | Penteno |
| 6 | C 6 H 14 | hexano | C 6 H 12 | hexeno |
| 7 | C 7 H 16 | Heptano | C 7 H 14 | hepteno |
| 8 | C 8 H 18 | Octano | C 8 H 16 | Octeno |
| 9 | C 9 H 20 | nonano | C 9 H 18 | Nonene |
| 10 | C 10 H 22 | decano | C 10 H 20 | deceno |
Os compostos do buteno ao deceno podem ter ramificações em locais iguais de átomos de carbono, portanto, também podem ser chamados de but-1-eno, hept-1-eno ou dec-1-eno. Isso significa que a ligação insaturada está presente entre os átomos de carbono que iniciam a cadeia. O fenômeno das várias possibilidades de colocação da ligação múltipla insaturada é chamado de isomeria posicional. Por exemplo, um composto com a fórmula molecular C 7 H 14 tem vários isômeros posicionais possíveis. A dupla ligação em sua estrutura pode estar localizada, por exemplo, nos átomos de carbono número um e três, conforme mostra a Figura 3.
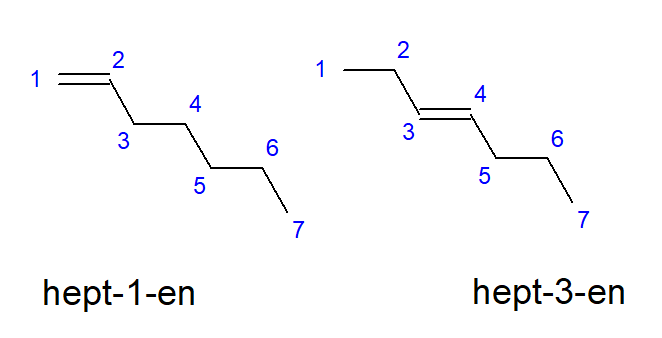
Figura 3. Fórmulas estruturais de hept-1-eno (1-hepteno) e hept-3-eno (3-hepteno)
Estrutura dos alcenos – resumo
Cada alceno tem uma ligação pi dupla (π) na qual estruturas planas são criadas. Os átomos de carbono têm uma hibridação sp 2 , caracterizada por uma forma trigonal. Em locais saturados, os grupos –CH 2 – metileno podem criar cadeias retas e ramificadas espacialmente expandidas. A rotação ocorre apenas em torno das ligações simples e não ocorre no caso da ligação C=C. As propriedades físicas e químicas básicas do grupo dos alcenos Os alcenos têm propriedades hidrofóbicas e, portanto, são de natureza apolar. Eles entram em reações com a água. Devido à sua afinidade, eles se dissolvem bem em solventes apolares, como alcanos. O ponto de fusão, o ponto de ebulição e a densidade dos alcenos aumentam à medida que aumenta o número de átomos de carbono na molécula. Sua atividade é maior em alcenos de cadeia curta.
Obtenção de alcenos
Existem várias maneiras de obter alcenos. Cada uma dessas formas é baseada na eliminação de dois substituintes em uma única ligação, conforme mostrado no diagrama:
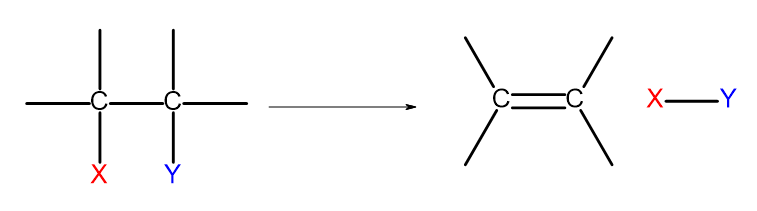
Figura 4. Esquema do processo de eliminação que resulta na formação de um alceno
Obtenção de eteno
1. Desidrogenação de um alcano 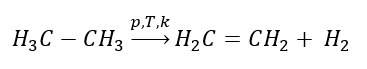 2. Desidratação de um álcool
2. Desidratação de um álcool 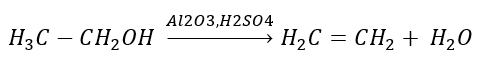 3. A reação de um halogênio-alcano com uma base forte
3. A reação de um halogênio-alcano com uma base forte 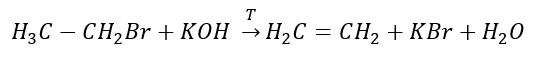 4. A reação de um dihalógeno-alcano com pó de zinco
4. A reação de um dihalógeno-alcano com pó de zinco 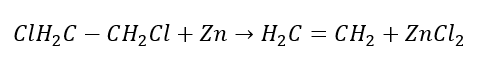 5. Hidrogenação de um alcino
5. Hidrogenação de um alcino 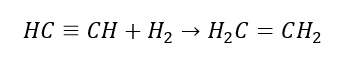
Reações químicas de alcenos
Um fragmento específico de partícula, que ao mesmo tempo define suas propriedades e afiliação, é chamado de grupo funcional. Para alcenos, este grupo é uma ligação dupla (C=C). A ligação pi (π) que ele contém é muito suscetível à quebra. Em comparação com os elétrons das ligações sigma, os elétrons que ocupam o orbital pi estão mais distantes dos átomos de carbono e, portanto, estão menos associados a eles. Isso resulta em sua maior mobilidade e maior disponibilidade para aproximar os reagentes, resultando em uma alta reatividade química da ligação. Existem vários tipos de reações segundo as quais os alcenos são transformados. São elas: adição eletrofílica, adição de radicais livres, oxidação e redução, polimerização e substituição alílica.
adição eletrofílica
Devido à natureza dos elétrons da ligação pi, os agentes que os atacam possuem um caráter eletropositivo. Tais moléculas são reagentes eletrofílicos que possuem uma alta afinidade por elétrons. Na maioria dos casos, esse fator é um próton de origem ácida, um gap de elétrons ou uma molécula que é facilmente polarizada por estar próxima aos elétrons pi. A adição, ou seja, a reação de ligação, segue o mecanismo do íon. Este é um mecanismo de duas etapas pelo qual um reagente eletrofílico que se aproxima inicialmente captura os elétrons da ligação pi com a criação de uma ligação simples e a formação de um carbocátion transiente. Essa molécula altamente reativa ataca rapidamente outros reagentes que têm a capacidade de mutualizar elétrons. Exemplos de tais reações são adições de cloro ou bromo a um alceno. O hidrogênio também pode ser adicionado (hidrogenação) por adição, mas não é eletrofílico.
Reações de adição de radicais livres
Muitas reações de alcenos mostram não conformidade com a regra de Markovnikov. Seu mecanismo se concentra na reação dos elétrons da ligação pi aos radicais livres, durante os quais uma ligação de partícula de ataque ao carbono é produzida. Como resultado dessas mudanças, um novo radical livre é obtido, que possui um elétron desemparelhado no átomo de carbono vizinho.
substituição alílica
Além da reação envolvendo a ligação dupla, os alcenos também podem reagir de maneira semelhante à dos alcanos em grupos alquil vizinhos. Um exemplo dessa reação é a substituição de um átomo de hidrogênio por halogênio no átomo próximo ao átomo de carbono que forma a ligação dupla. Esta reação não afeta a parte insaturada da estrutura.

