Les alcènes sont des hydrocarbures insaturés qui, comme les alcanes, forment une série homologue. Cependant, contrairement aux alcanes, les alcènes ont une liaison multiple - une double liaison - entre les atomes de carbone. Les autres sont des liaisons simples, mais la présence d'une seule liaison multiple dans une molécule fait de l'hydrocarbure un composé insaturé.

La structure des alcènes
La liaison CC entre les atomes dans les hydrocarbures saturés amène chacun d’eux à avoir une hybridation sp 3 . Dans les alcènes, qui ont des liaisons C=C, il se produit une hybridation sp 2 . Cette propriété fait que la structure des composés à doubles liaisons est une forme trigonale. Ses 3 liaisons sigma sont dans le même plan et font face aux angles du triangle équilatéral dont le centre est l’atome de carbone. En revanche, les liaisons pi résultent du chevauchement d’une orbitale p non hybride dans une direction perpendiculaire au triangle, qui est formée d’orbitales hybrides et des orbitales de symétrie similaire de l’atome voisin. La construction la plus simple du groupe, et le premier composé de la série homologue des alcènes, est l’éthène. Le méthane, un composé qui est le premier des alcanes, ne pouvait pas former de liaison multiple.
Un exemple de la structure de l’alcène
Prenons le composé le plus simple du groupe, l’éthène, et examinons sa structure. Nous savons que les atomes de carbone dans la molécule d’éthène ont une hybridation sp 2 , donc la molécule est plate. Les angles entre les liaisons dans cette disposition sont de 120 o . Les quatre liaisons entre les atomes de carbone et d’hydrogène présents dans la structure CH sont des liaisons sigma δ SP-s à recouvrement frontal. Il existe également des liaisons homonucléaires formées entre les atomes de carbone. L’un est CC δ sp-sp et l’autre est CC π pp , qui est formé d’orbitales p non hybrides.
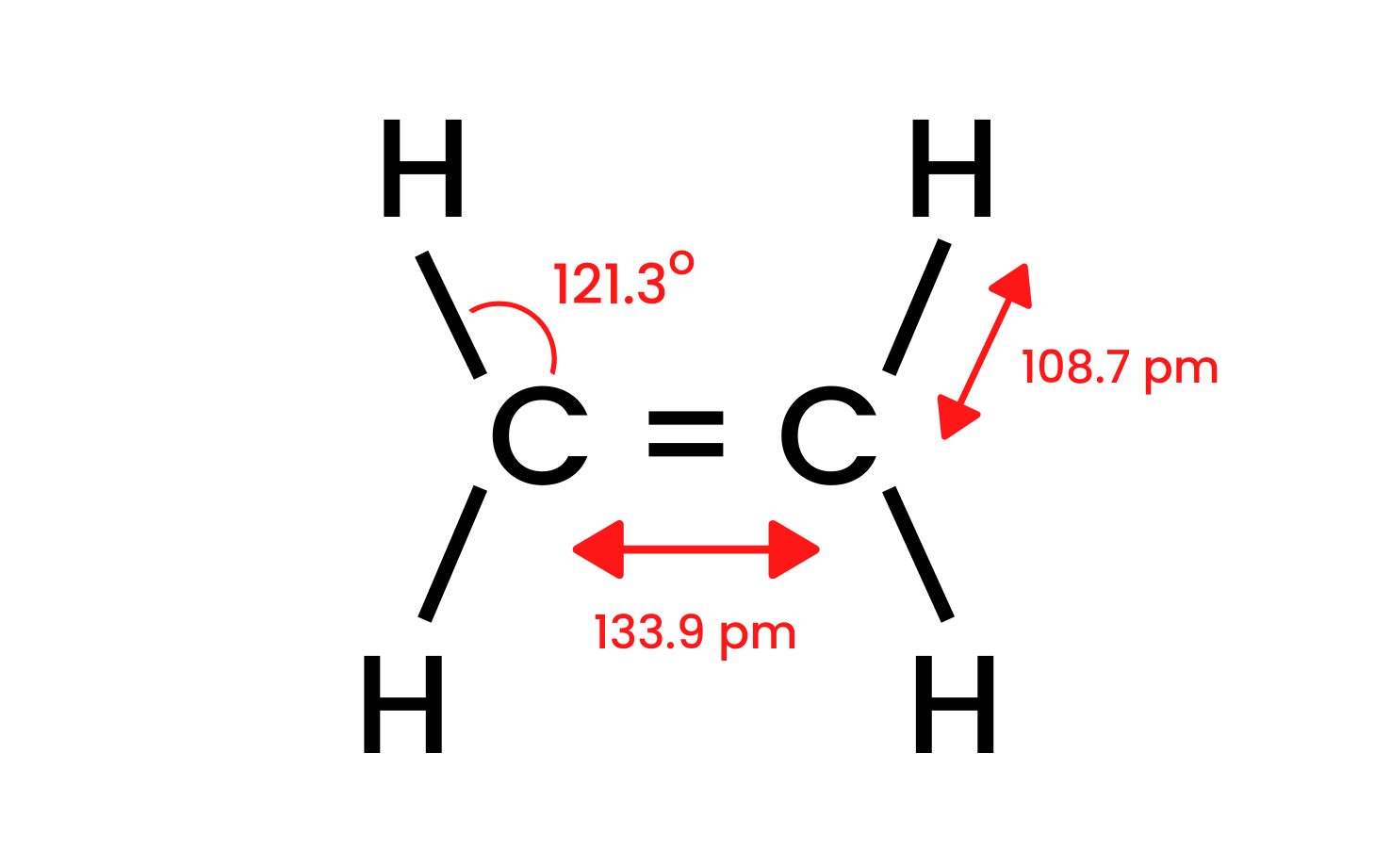
Figure 1. La structure de l’éthène
Série homologue d’alcène
Une série homologue est un groupe de composés chimiques qui ont une structure chimique et des propriétés très similaires. De telles substances peuvent également être écrites avec une formule moléculaire commune. La formule générale des alcènes peut s’écrire C n H 2n . Structurellement, cela ressemble à ceci :
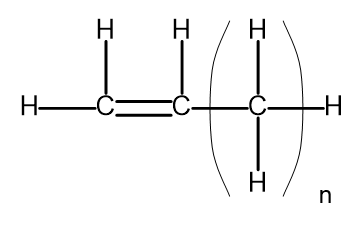
Figure 2. Formule structurelle générale des alcènes
| Nombre d’atomes de carbone dans la chaîne | Formule alcane | Nom de l’alcane | Formule alcène | Nom de l’alcène |
| 2 | C 2 H 6 | Éthane | C2H4 _ | Éthène |
| 3 | C 3 H 8 | Propane | C 3 H 6 | Propène |
| 4 | C 4 H 10 | Butane | C 4 H 8 | Butène |
| 5 | C 5 H 12 | Pentane | C 5 H 10 | Pentène |
| 6 | C 6 H 14 | Hexane | C 6 H 12 | Hexène |
| sept | C 7 H 16 | Heptane | C 7 H 14 | Heptène |
| 8 | C 8 H 18 | Octane | C 8 H 16 | Octène |
| 9 | C 9 H 20 | Nonane | C 9 H 18 | Nonène |
| dix | C 10 H 22 | Décane | C 10 H 20 | Décène |
Les composés du butène au décène peuvent avoir des ramifications à des emplacements égaux d’atomes de carbone, ils peuvent donc également être appelés but-1-ène, hept-1-ène ou déc-1-ène. Cela signifie que la liaison insaturée est présente entre les atomes de carbone qui démarrent la chaîne. Le phénomène des diverses possibilités de placement de la liaison multiple insaturée est appelé isomérie positionnelle. Par exemple, un composé de formule moléculaire C 7 H 14 a plusieurs isomères de position possibles. La double liaison dans sa structure peut être située, par exemple, au niveau des atomes de carbone numéro un et trois, comme le montre la figure 3.
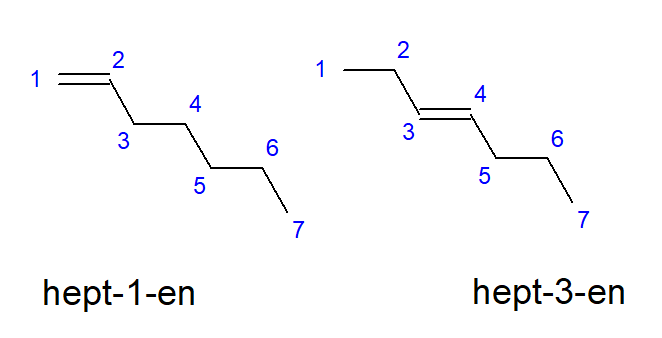
Figure 3. Formules développées de l’hept-1-ène (1-heptène) et de l’hept-3-ène (3-heptène)
Structure des alcènes – résumé
Chaque alcène a une double liaison pi (π) au niveau de laquelle des structures plates sont créées. Les atomes de carbone ont une hybridation sp 2 , caractérisée par une forme trigonale. Dans les endroits saturés, les groupes –CH 2 – méthylène peuvent créer des chaînes droites et ramifiées spatialement étendues. La rotation se produit uniquement autour des liaisons simples et ne se produit pas dans le cas de la liaison C=C. Les propriétés physiques et chimiques de base du groupe des alcènes Les alcènes ont des propriétés hydrophobes et ont donc un caractère non polaire. Ils entrent en réaction avec l’eau. En raison de leur affinité, ils se dissolvent bien dans les solvants non polaires tels que les alcanes. Le point de fusion, le point d’ébullition et la densité des alcènes augmentent à mesure que le nombre d’atomes de carbone dans la molécule augmente. Leur activité est la plus importante dans les alcènes à chaîne courte.
Obtention d’alcènes
Il existe plusieurs façons d’obtenir des alcènes. Chacune de ces méthodes est basée sur l’élimination de deux substituants au niveau d’une simple liaison, comme indiqué sur le schéma :
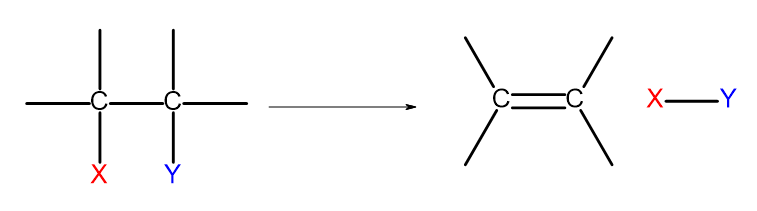
Figure 4. Le schéma du processus d’élimination aboutissant à la formation d’un alcène
Obtention d’éthylène
1. Déshydrogénation d’un alcane 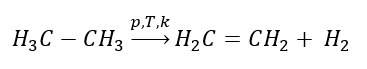 2. Déshydratation d’un alcool
2. Déshydratation d’un alcool 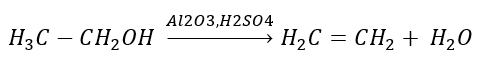 3. La réaction d’un halogène-alcane avec une base forte
3. La réaction d’un halogène-alcane avec une base forte 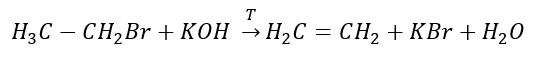 4. La réaction d’un dihalogène-alcane avec de la poussière de zinc
4. La réaction d’un dihalogène-alcane avec de la poussière de zinc 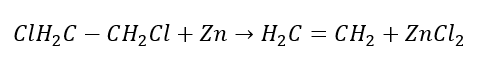 5. Hydrogénation d’un alcyne
5. Hydrogénation d’un alcyne 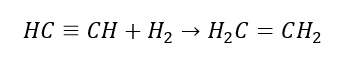
Réactions chimiques des alcènes
Un fragment spécifique à une particule, qui définit en même temps ses propriétés et son affiliation, est appelé groupe fonctionnel. Pour les alcènes, ce groupe est une double liaison (C=C). La liaison pi (π) qu’il contient est très susceptible de se rompre. Comparés aux électrons des liaisons sigma, les électrons qui occupent l’orbitale pi sont plus éloignés des atomes de carbone et leur sont donc moins associés. Il en résulte une plus grande mobilité et une plus grande disponibilité pour les réactifs d’approche, ce qui se traduit par une réactivité chimique élevée de la liaison. Il existe plusieurs types de réactions selon lesquelles les alcènes se transforment. Ce sont : l’addition électrophile, l’addition de radicaux libres, l’oxydation et la réduction, la polymérisation et la substitution allylique.
Addition électrophile
En raison de la nature des électrons de la liaison pi, les agents qui les attaquent ont un caractère électropositif. De telles molécules sont des réactifs électrophiles qui ont une forte affinité pour les électrons. Dans la plupart des cas, ce facteur est un proton d’origine acide, un trou électronique ou une molécule qui se polarise facilement du fait de sa proximité avec les électrons pi. L’addition, c’est-à-dire la réaction de connexion, suit le mécanisme ionique. Il s’agit d’un mécanisme en deux étapes par lequel un réactif électrophile initialement approchant capture les électrons de la liaison pi avec la création d’une liaison simple et la formation d’un carbocation transitoire. Cette molécule très réactive attaque rapidement d’autres réactifs qui ont la capacité de mutualiser les électrons. Des exemples de telles réactions sont des additions de chlore ou de brome à un alcène. L’hydrogène peut également être ajouté (hydrogénation) par addition, mais il n’est pas électrophile.
Réactions d’addition de radicaux libres
De nombreuses réactions d’alcènes montrent le non-respect de la règle de Markovnikov. Leur mécanisme se concentre sur la réaction des électrons de la liaison pi aux radicaux libres, au cours de laquelle une liaison de particules attaquant le carbone est produite. À la suite de ces changements, un nouveau radical libre est obtenu, qui a un électron non apparié sur l’atome de carbone voisin.
Substitution allylique
En plus de la réaction impliquant la double liaison, les alcènes peuvent également réagir d’une manière similaire à celle des alcanes dans les groupes alkyle voisins. Un exemple d’une telle réaction est la substitution d’un atome d’hydrogène par un halogène au niveau de l’atome à côté de l’atome de carbone qui forme la double liaison. Cette réaction n’affecte pas la partie insaturée de la structure.

