Alkeny jsou nenasycené uhlovodíky, které stejně jako alkany tvoří homologní řadu. Na rozdíl od alkanů však mají alkeny jednu násobnou vazbu – dvojnou – mezi atomy uhlíku. Zbývající jsou jednoduché vazby, ale výskyt byť jedné násobné vazby v molekule činí z uhlovodíku nenasycenou sloučeninu.

Struktura alkenů
Vazba CC mezi atomy v nasycených uhlovodících způsobuje, že každý z nich má hybridizaci sp3 . V alkenech, které mají vazby C=C, dochází k hybridizaci sp2 . Tato vlastnost způsobuje, že struktura sloučenin s dvojnými vazbami je trigonální forma. Jeho 3 sigma vazby jsou ve stejné rovině a směřují k rohům rovnostranného trojúhelníku, jehož středem je atom uhlíku. Naproti tomu vazby pí jsou výsledkem překrývání nehybridního orbitalu p ve směru kolmém k trojúhelníku, který je vytvořen z hybridních orbitalů a orbitalů podobné symetrie sousedního atomu. Nejjednodušší konstrukcí skupiny a první sloučeninou v řadě homologních alkenů je ethen. Metan, sloučenina, která je prvním z alkanů, nemohl vytvořit násobnou vazbu.
Příklad struktury alkenu
Vezměme nejjednodušší sloučeninu skupiny, ethen, a prozkoumejme její strukturu. Víme, že atomy uhlíku v molekule ethenu mají hybridizaci sp2 , takže molekula je plochá. Úhly mezi vazbami v tomto rozložení jsou 120 ° . Čtyři vazby mezi atomy uhlíku a vodíku přítomnými ve struktuře CH jsou sigma δ SP-s vazby s přímým přesahem. Mezi atomy uhlíku jsou také vytvořeny homonukleární vazby. Jedním je CC δ sp-sp a druhým je CC π pp , který je tvořen nehybridními p orbitaly.
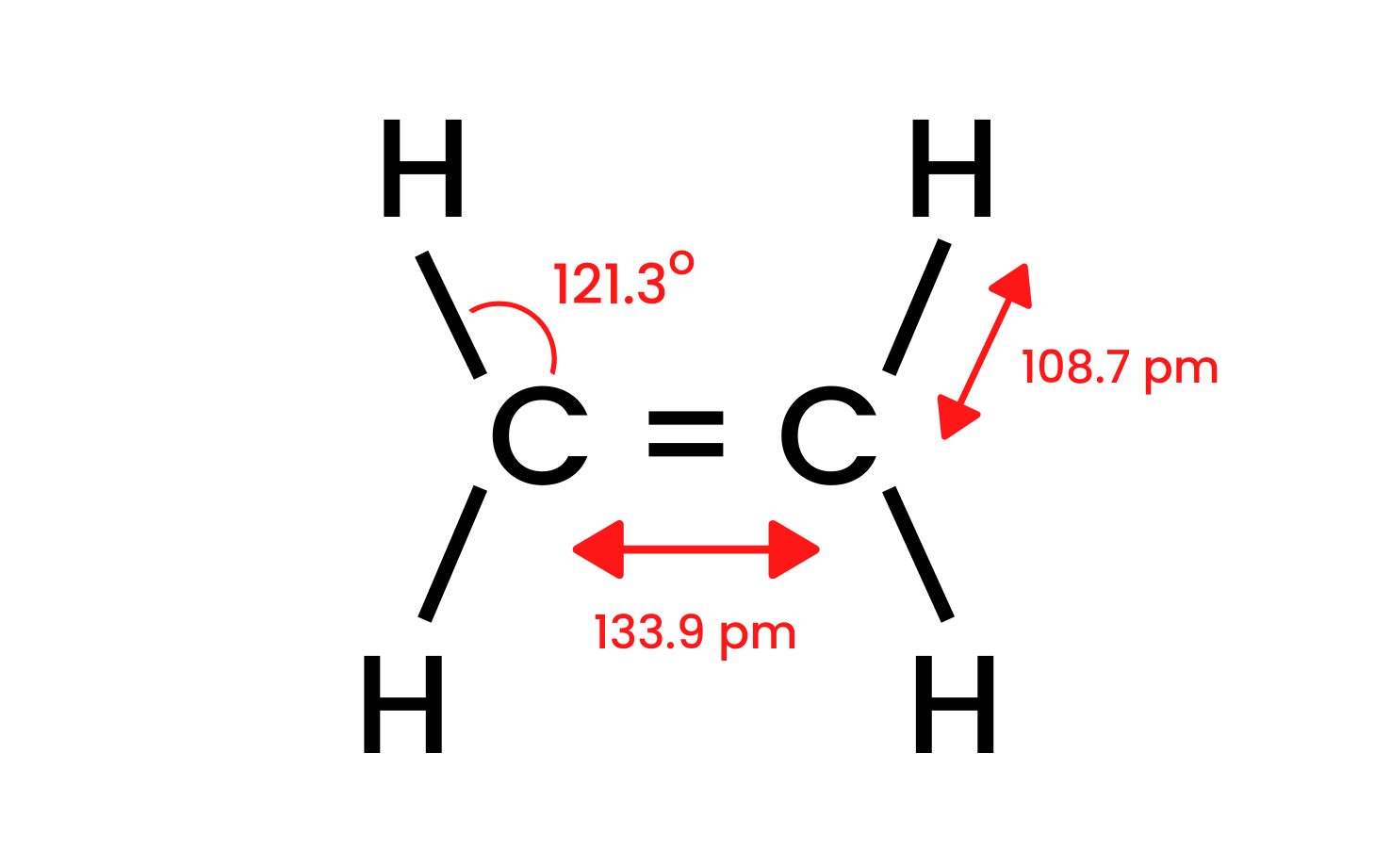
Obrázek 1. Struktura ethenu
Alkenová homologická řada
Homologní řada je skupina chemických sloučenin, které mají velmi podobnou chemickou strukturu a vlastnosti. Takové látky mohou být také zapsány s běžným molekulárním vzorcem. Obecný vzorec pro alkeny lze zapsat jako CnH2n . Strukturálně to vypadá takto:
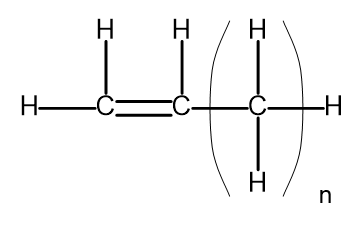
Obrázek 2. Obecný strukturní vzorec pro alkeny
| Počet atomů uhlíku v řetězci | Alkanový vzorec | Alkanové jméno | Alkenový vzorec | Jméno alken |
| 2 | C2H6 _ | Etan | C2H4 _ | Ethene |
| 3 | C3H8 _ | Propan | C3H6 _ | Propen |
| 4 | C4H10 _ | Butan | C4H8 _ | buten |
| 5 | C5H12 _ | pentan | C5H10 _ | Pentene |
| 6 | C6H14 _ | Hexan | C6H12 _ | Hexene |
| 7 | C7H16 _ | Heptan | C7H14 _ | hepten |
| 8 | C 8H 18 | Oktan | C 8H 16 | Octene |
| 9 | C9H20 _ | Nonane | C9H18 _ | None |
| 10 | C10H22 _ | Dekane | C10H20 _ | Decene |
Sloučeniny od butenu po decen mohou mít větve na stejných místech atomů uhlíku, takže mohou být také nazývány but-1-en, hept-1-en nebo dec-1-en. To znamená, že nenasycená vazba je přítomna mezi atomy uhlíku, které začínají řetězec. Jev různých možností umístění nenasycené násobné vazby se nazývá poziční izomerie. Například sloučenina s molekulovým vzorcem C7H14 má několik možných polohových izomerů. Dvojná vazba v její struktuře může být umístěna například na atomech uhlíku číslo jedna a tři, jak ukazuje obrázek 3.
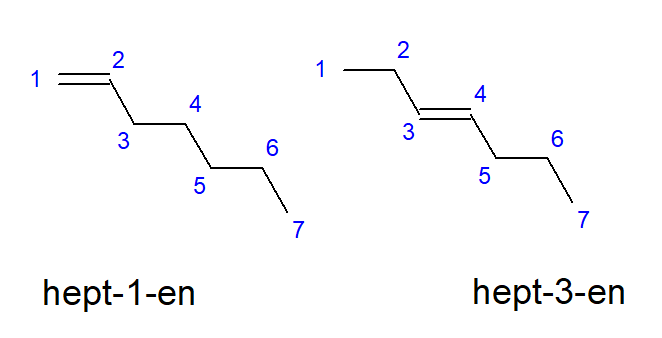
Obrázek 3. Strukturní vzorce hept-1-enu (1-hepten) a hept-3-enu (3-hepten)
Struktura alkenů – shrnutí
Každý alken má dvojnou pí vazbu (π), na které se vytvářejí ploché struktury. Atomy uhlíku mají hybridizaci sp2 , vyznačující se trigonální formou. V nasycených lokalitách mohou –CH 2 – methylenové skupiny vytvářet prostorově expandované přímé a rozvětvené řetězce. K rotaci dochází pouze kolem jednoduchých vazeb a nenastává v případě vazby C=C. Základní fyzikální a chemické vlastnosti skupiny alkenů Alkeny mají hydrofobní vlastnosti, a proto mají nepolární povahu. Vstupují do reakcí s vodou. Díky své afinitě se dobře rozpouštějí v nepolárních rozpouštědlech, jako jsou alkany. Teplota tání, bod varu a hustota alkenů se zvyšují se zvyšujícím se počtem atomů uhlíku v molekule. Jejich aktivita je největší u alkenů s krátkým řetězcem.
Získávání alkenů
Existuje několik způsobů, jak získat alkeny. Každý z těchto způsobů je založen na eliminaci dvou substituentů na jednoduché vazbě, jak je znázorněno na diagramu:
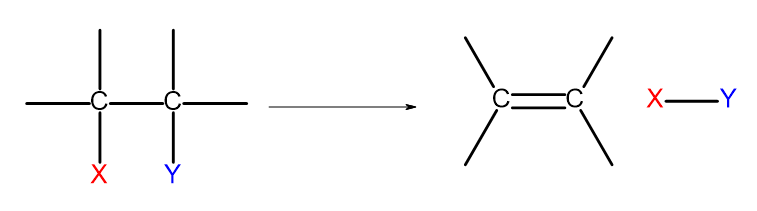
Obrázek 4. Diagram eliminačního procesu, který vede ke vzniku alken
Získávání ethenu
1. Dehydrogenace alkanu 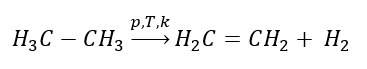 2. Dehydratace alkoholu
2. Dehydratace alkoholu 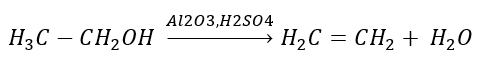 3. Reakce halogen-alkanu se silnou bází
3. Reakce halogen-alkanu se silnou bází 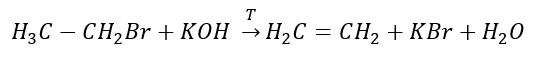 4. Reakce dihalogenalkanu se zinkovým prachem
4. Reakce dihalogenalkanu se zinkovým prachem 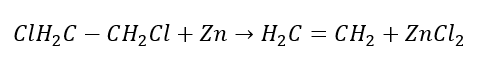 5. Hydrogenace alkynu
5. Hydrogenace alkynu 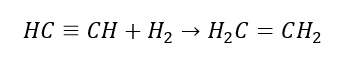
Chemické reakce alkenů
Částečně specifický fragment, který zároveň definuje jeho vlastnosti a příslušnost, se nazývá funkční skupina. U alkenů je tato skupina dvojná vazba (C=C). Vazba pí (π), kterou obsahuje, je velmi náchylná k porušení. Ve srovnání s elektrony sigma vazeb jsou elektrony, které okupují orbital pí, dále od atomů uhlíku, a proto jsou s nimi méně spojeny. To má za následek jejich větší mobilitu a větší dostupnost pro blížící se činidla, což má za následek vysokou chemickou reaktivitu vazby. Existuje několik typů reakcí, podle kterých se alkeny přeměňují. Jsou to: elektrofilní adice, adice volných radikálů, oxidace a redukce, polymerace a allylová substituce.
Elektrofilní adice
Vzhledem k povaze elektronů pí vazby mají činidla, která je napadají, elektropozitivní charakter. Takové molekuly jsou elektrofilní činidla, která mají vysokou afinitu k elektronům. Ve většině případů je tímto faktorem proton kyselého původu, elektronová mezera nebo molekula, která se snadno polarizuje v důsledku blízkosti pí elektronů. Adice, tj. spojovací reakce, sleduje iontový mechanismus. Jedná se o dvoustupňový mechanismus, při kterém zpočátku blížící se elektrofilní činidlo zachycuje elektrony pí vazby s vytvořením jednoduché vazby a vytvořením přechodného karbokationtu. Tato vysoce reaktivní molekula rychle útočí na další činidla, která mají schopnost vzájemných elektronů. Příklady takových reakcí jsou adice chloru nebo bromu k alkenu. Vodík může být také přidán (hydrogenizace) adicí, ale není elektrofilní.
Adiční reakce s volnými radikály
Mnoho reakcí alkenů ukazuje nedodržování Markovnikovova pravidla. Jejich mechanismus se soustředí na reakci elektronů pí vazby na volné radikály, při které vzniká uhlíková vazba částic. V důsledku těchto změn se získá nový volný radikál, který má na sousedním atomu uhlíku nepárový elektron.
Alylická substituce
Kromě reakce zahrnující dvojnou vazbu mohou alkeny také reagovat způsobem, který je podobný jako u alkanů v sousedních alkylových skupinách. Příkladem takové reakce je substituce atomu vodíku halogenem na atomu vedle atomu uhlíku, který tvoří dvojnou vazbu. Tato reakce neovlivňuje nenasycenou část struktury.

