Alkeny są to węglowodory nienasycone, które podobnie jak alkany, tworzą szereg homologiczny. W przeciwieństwie do nich, w cząsteczkach alkenów występuje pomiędzy atomami węgla jedno wiązanie wielokrotne – podwójne. Pozostałe z nich są wiązaniami pojedynczymi, jednak wystąpienie w cząsteczce nawet jednego wiązania wielokrotnego sprawia, że węglowodór staje się związkiem nienasyconym.

Budowa alkenów
Występujące w nasyconych węglowodorach wiązanie pomiędzy atomami C-C sprawia, że każdy z nich posiada hybrydyzację sp3. W alkenach, posiadających wiązania C=C, występuje natomiast hybrydyzacja typu sp2. Ta właściwość sprawia, że budowa związków o podwójnym wiązaniu, przyjmuje postać trygonalną. 3 wiązania typu sigma znajdują się w tej samej płaszczyźnie i są skierowane w stronę naroży trójkąta równobocznego, którego centrum stanowi atom węgla. Natomiast, wiązanie typu pi powstaje w wyniku nakładania się niezhybrydyzowanego orbitalu typu p, leżącego w kierunku prostopadłym do trójkąta, który jest tworzony ze zhybrydyzowanych orbitali oraz arbitali o podobnej symetrii sąsiedniego atomu. Najprostszą budowę grupy, oraz pierwszy związek w szeregu homologicznym alkenów, stanowi eten. Metan, będący związkiem rozpoczynającym alkany nie mógłby wytworzyć wiązania wielokrotnego.
Przykładowa budowa alkenu
Biorąc pod uwagę najprostszy związek grupy – eten, możemy przedstawić model budowy. Wiemy, że atomy węgla w cząsteczce etenu ulegają hybrydyzacji sp2, a więc cząsteczka jest płaska. Kąty w takim układzie, pomiędzy wiązaniami wynoszą 120o. Obecne w strukturze cztery wiązania pomiędzy atomami węgla i wodoru, C-H są wiązaniami typu czołowego sigma δsp-s. Widoczne są również wiązania homojądrowe, wytwarzane pomiędzy atomami węgla. Jedno C-C typu δsp-sp oraz drugie C-C typu πp-p, które powstaje z niezhybrydyzowanych orbitali p.
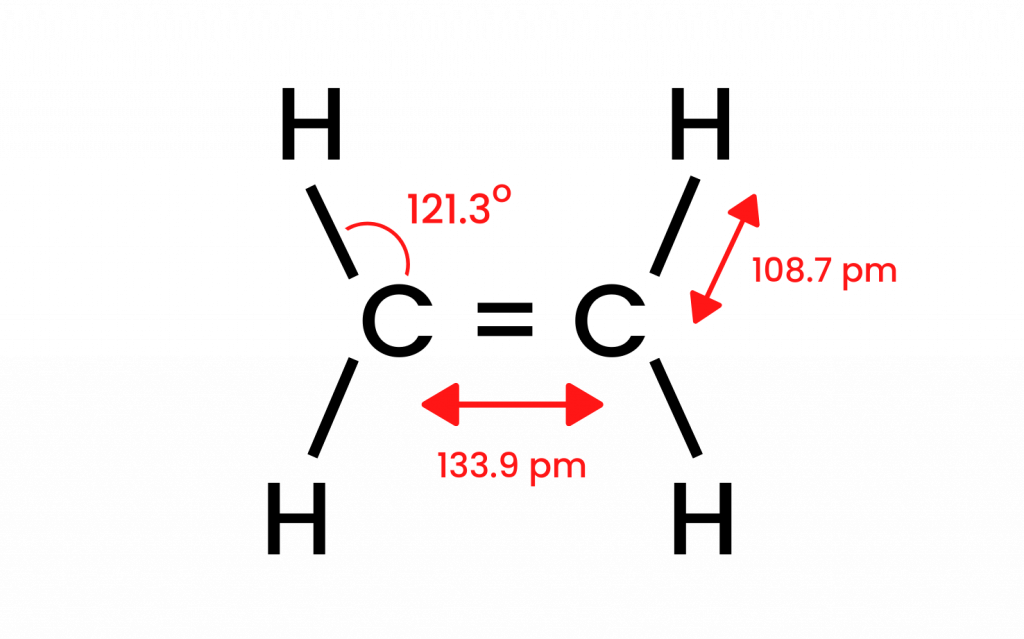
Rysunek 1 Budowa strukturalna etenu.
Szereg homologiczny alkenów
Szeregiem homologicznym nazywamy zbiór związków chemicznych, które charakteryzują się bardzo zbliżoną budową chemiczną oraz właściwościami. Takie substancje możemy również zapisać wspólnym wzorem sumarycznym.
Ogólny wzór alkenów można zapisać w postaci CnH2n. Strukturalnie, wygląda następująco:
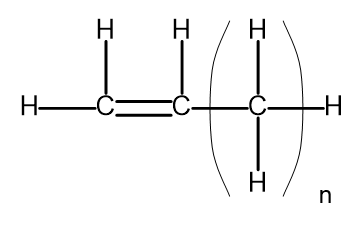
Rysunek 2 Ogólny wzór strukturalny alkenów.
Podobnie jak węglowodory nasycone, alkeny również tworzą swój szereg homologiczny, który zaczynający się od etenu, a kończący na decenie. Nazwa alkenu pochodzi od nazwy analogicznego mu alkanu, o tej samej liczbie atomów węgla w cząsteczce. Różnicą jest używana końcówka, która w przypadku alkanów brzmi –an, natomiast dla alkenów to –en, na przykład pentan-penten.
| Liczba atomów węgla w łańcuchu | Wzór alkanu | Nazwa alkanu | Wzór alkenu | Nazwa alkenu |
| 2 | C2H6 | Etan | C2H4 | Eten |
| 3 | C3H8 | Propan | C3H6 | Propen |
| 4 | C4H10 | Butan | C4H8 | Buten |
| 5 | C5H12 | Pentan | C5H10 | Penten |
| 6 | C6H14 | Heksan | C6H12 | Heksen |
| 7 | C7H16 | Heptan | C7H14 | Hepten |
| 8 | C8H18 | Oktan | C8H16 | Okten |
| 9 | C9H20 | Nonan | C9H18 | Nonen |
| 10 | C10H22 | Dekan | C10H20 | Deken |
Związki, od butenu do decenu, mogą posiadać rozgałęzienia przy równych lokacjach atomów węgla, dlatego inaczej, można je nazywać jako but-1-en, hept-1-en czy też dec-1-en. Oznacza to, że wiązanie nienasycone znajduje się pomiędzy węglami rozpoczynającymi łańcuch. Zjawisko różnych możliwości umiejscowienia nienasyconego wiązania wielokrotnego nazywa się izomerią położeniową. Przykładowo, związek o wzorze sumarycznym C7H14 ma kilka możliwych izomerii położeniowych. Znajdujące się w jego strukturze wiązanie podwójne może być zlokalizowane, na przykład przy atomach węglu numer jeden oraz trzy, tak jak na Rysunku 3.
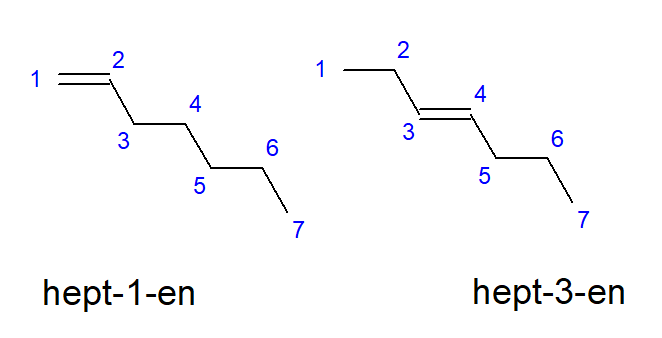
Rysunek 3 Wzory strukturalne hept-1-enu (1-hepten) oraz hept-3-enu (3-hepten)
Podsumowanie struktur alkenów
Każdy alken posiada wiązanie podwójne pi (π), przy którym tworzone są płaskie struktury. Atomy węgla posiadają hybrydyzację sp2, charakteryzującą się budową trygonalną. W miejscach nasyconych, grupy metylenowe –CH2– mogą tworzyć rozbudowane przestrzennie łańcuchy proste oraz rozgałęzione. Rotacja występuje wyłącznie dookoła wiązań pojedynczych, nie występuje w przypadku wiązania C=C.
Podstawowe właściwości fizykochemiczne grupy alkenów
Alkeny posiadają właściwości hydrofobowe, a więc mają charakter niepolarny. Wchodzą w reakcje z wodą. Ze względu na powinowactwo, dobrze rozpuszczają się w rozpuszczalnikach niepolarnych, takich jak alkany. Temperatura topnienia, temperatura wrzenia oraz gęstość alkenów wzrasta wraz ze wzrostem ilości atomów węgla w cząsteczce. Przeciwnie zachowuje się natomiast ich aktywność – największa aktywność charakteryzuje alkeny o krótkich łańcuchach węglowych.
Otrzymywanie alkenów
Istnieje kilka dróg pozyskania związków alkenowych. Podstawą każdej z nich jest reakcja eliminacji dwóch podstawników przy wiązaniu pojedynczym, według schematu:
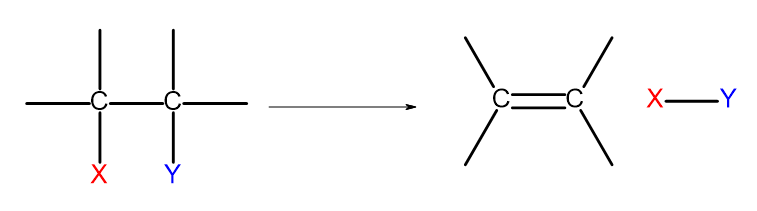
Rysunek 4 Schemat procesu eliminacji, skutkujący powstaniem alkenu.
Ogólnikowo, są to reakcje dehydrogenacji alkanu, dehydratacji alkoholu, reakcji halogenoalkanu z silną zasadą, reakcja dihalogenoalkanu z pyłem cynkowym oraz hydrogenacja alkinu.
Otrzymywanie etenu
1. Dehydrogenacja alkanu
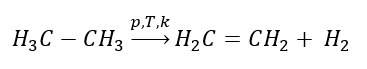
2. Dehydratacja (odwodnienie) alkoholu
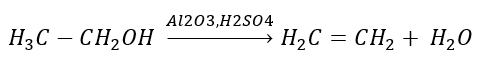
3. Reakcja halogenoalkanu z silną zasadą
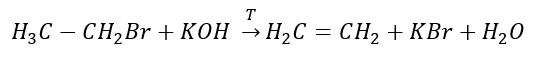
4. Reakcja dihalogenoalkanu z pyłem cynkowym
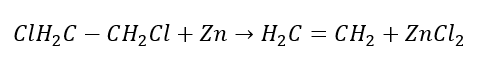
5. Hydrogenacja (uwodornienie) alkinu
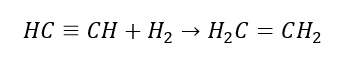
Reakcje chemiczne alkenów
Grupą funkcyjną nazywamy charakterystyczny dla cząsteczki fragment, który jednocześnie określa nam jej przynależność i właściwości. Dla alkenów, taką grupą jest wiązanie podwójne C=C. Zawarte w nim wiązanie typu pi (π) jest bardzo podatne na rozerwanie. Elektrony, zajmujące orbital pi są dalej od atomów węgla, w porównaniu z elektronami wiązań sigma, a więc są z nimi słabiej związane. Skutkuje to ich większą ruchliwością oraz większą dostępnością dla zbliżających się reagentów, przez co wiązanie wykazuje dużą reaktywność chemiczną. Istnieje kilka typów reakcji, według których następują przemiany alkenów. Są to: addycja elektrofilowa, addycja wolnorodnikowa, utlenianie i redukcja, polimeryzacja oraz podstawienie w pozycji allilowej.
Addycja elektrofilowa
Ze względu na charakter elektronów wiązania pi, czynniki które je atakują mają charakter elektrododatni. Takie molekuły stanowią odczynniki elektrofilowe, wykazujące duże powinowactwo do elektronów. W większości przypadków, taki czynnik stanowi proton pochodzenia kwasowego, luka elektronowa lub cząsteczka, która łatwo polaryzuje się pod wpływem zbliżania do elektronów pi. Reakcja addycji, czyli przyłączenia przebiega według mechanizmu jonowego. Jest to mechanizm dwuetapowy, gdzie początkowo zbliżający się odczynnik elektrofilowy przechwytuje elektrony wiązania pi z wytworzeniem pojedynczego wiązania oraz utworzeniem przejściowego karbokationu. Ta bardzo reaktywna cząsteczka szybko atakuje inne reagenty, które mają możliwość do uwspólnienia elektronów. Przykładami takich reakcji są addycje do alkenu chloru, bromu. Możliwa jest również addycja wodoru (hydrogenacja) w mechanizmie addycji, jednak już nie elektrofilowej.
Reakcje addycji wolnorodnikowej
Wiele reakcji, którym poddaje się alkeny wykazują niezgodność z regułą Markownikowa. Ich mechanizm skupia się bowiem na reakcji elektronów wiązania pi z wolnymi rodnikami, podczas której wytwarza się wiązanie węgiel-cząstka atakująca. W wyniku takich przemian otrzymuje się nowy wolny rodnik, który posiada niesparowany elektron przy sąsiednim atomie węgla.
Podstawienie w pozycji allilowej
Oprócz reakcji z udziałem wiązania podwójnego, alkeny mogą również reagować w podobny sposób jak alkany, w sąsiednich grupach alkilowych. Przykładem takiej reakcji może być podstawienie atomu wodoru halogenem, przy atomie sąsiadującym z atomem węgla wiązania podwójnego. Taka reakcja nie ma wpływu na nienasyconą część struktury.
