Alkene sind ungesättigte Kohlenwasserstoffe, die ähnlich wie Alkane eine homologe Reihe bilden. Im Gegensatz zu ihnen befindet sich in den Molekülen der Alkene zwischen den Kohlenstoffatomen eine Mehrfachbindung - eine Doppelbindung. Die anderen sind Einfachbindungen, aber das Vorkommen auch nur einer Mehrfachbindung im Molekül macht den Kohlenwasserstoff zu einer ungesättigten Verbindung.

Struktur von Alkenen
Die zwischen den Atomen C-C in gesättigten Kohlenwasserstoffen bestehende Bindung bewirkt, dass jedes dieser Atome eine Hybridisierung sp3 aufweist. Bei Alkenen hingegen, die Bindungen C=C aufweisen, liegt eine Hybridisierung sp2 vor. Diese Eigenschaft bewirkt, dass die Struktur von Verbindungen mit einer Doppelbindung eine trigonale Form annimmt. Die 3 Sigma-Bindungen liegen in derselben Ebene und zeigen zu den Ecken eines gleichseitigen Dreiecks, dessen Zentrum ein Kohlenstoffatom bildet. Im Gegensatz dazu wird eine pi-Bindung durch die Überlappung eines nicht hybridisierten p-Orbitals gebildet, das in der Richtung senkrecht zum Dreieck liegt, der aus hybridisierten Orbitalen und Arbitalen ähnlicher Symmetrie des Nachbaratoms gebildet wird. Die einfachste Gruppenstruktur und die erste Verbindung in der homologen Reihe der Alkene ist Ethen. Methan, die Ausgangsverbindung der Alkane, könnte keine Mehrfachbindung bilden.
Beispiel für eine Alkenstruktur
Anhand der einfachsten Verbindung der Gruppe, Ethen, können wir ein Modell der Struktur erstellen. Wir wissen, dass die Kohlenstoffatome im Ethen-Molekül einer Hybridisierung sp2 unterliegen, so dass das Molekül flach ist. Die Winkel zwischen den Bindungen betragen bei einer solchen Anordnung 120o. Die vier in der Struktur vorhandenen Bindungen zwischen den Kohlenstoff- und Wasserstoffatomen, C-H, sind Frontbindungen Sigma δsp-s. Homonukleare Bindungen, die zwischen Kohlenstoffatomen entstehen, sind ebenfalls sichtbar. Eine C-C des Typs δsp-sp und eine weitere C-C des Typs πp-p, die aus nicht-hybridisierten p-Orbitalen gebildet wird.
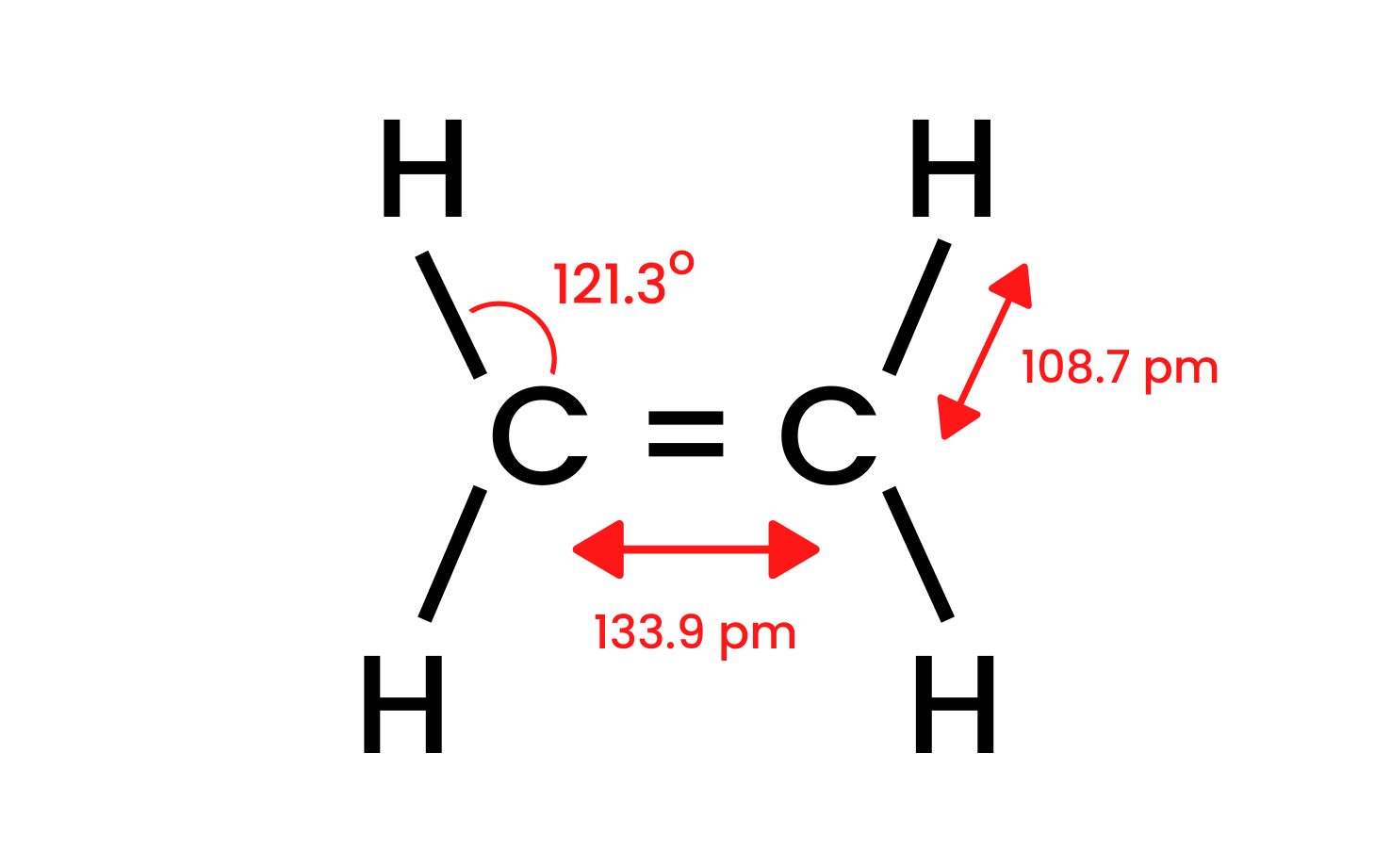
Abbildung 1Struktureller Aufbau von Ethen.
Homologe Reihe von Alkenen
Eine homologe Reihe ist eine Gruppe von chemischen Verbindungen, die sehr ähnliche chemische Strukturen und Eigenschaften aufweisen. Solche Stoffe können auch mit einer gemeinsamen Summenformel geschrieben werden.
Die allgemeine Formel von Alkenen kann in der Form CnH2n. Strukturell sieht es folgendermaßen aus:
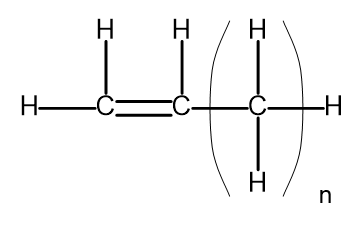
Abbildung 2 Allgemeine Strukturformel der Alkene.
Ähnlich wie die gesättigten Kohlenwasserstoffe bilden auch die Alkene ihre eigene homologe Reihe, die mit Ethen beginnt und mit Decen endet. Der Name Alken leitet sich von seinem Analogon Alkan ab, das die gleiche Anzahl von Kohlenstoffatomen im Molekül aufweist. Der Unterschied liegt in der verwendeten Endung, die bei Alkanen -an und bei Alkenen -en lautet, zum Beispiel Pentan-Penten.
| Anzahl der in der Kette vorhandenen Kohlenstoffatome | Formel des Alkan | Name des Alkans | Formel des Alkens | Name des Alkens |
| 2 | C2H6 | Ethan | C2H4 | Ethen |
| 3 | C3H8 | Propan | C3H6 | Propen |
| 4 | C4H10 | Butan | C4H8 | Buten |
| 5 | C5H12 | Pentan | C5H10 | Penten |
| 6 | C6H14 | Hexan | C6H12 | Hexen |
| 7 | C7H16 | Heptan | C7H14 | Hepten |
| 8 | C8H18 | Oktan | C8H16 | Okten |
| 9 | C9H20 | Nonan | C9H18 | Nonen |
| 10 | C10H22 | Dekan | C10H20 | Decen |
Verbindungen, von Buten bis Decen, können Verzweigungen an gleichen Kohlenstoffatomstellen aufweisen, so dass sie andernfalls als But-1-en, Hept-1-en oder Dec-1-en bezeichnet werden können. Das bedeutet, dass sich die ungesättigte Bindung zwischen den Anfangskohlenstoffen der Kette befindet. Das Phänomen der verschiedenen möglichen Positionen der ungesättigten Mehrfachbindung wird als Positionsisomerie bezeichnet. Eine Verbindung mit der Summenformel C7H14 zum Beispiel hat mehrere mögliche Positionsisomerien. Die Doppelbindung in seiner Struktur kann sich zum Beispiel an den Kohlenstoffatomen Nummer eins und drei befinden, wie in Abbildung 3.
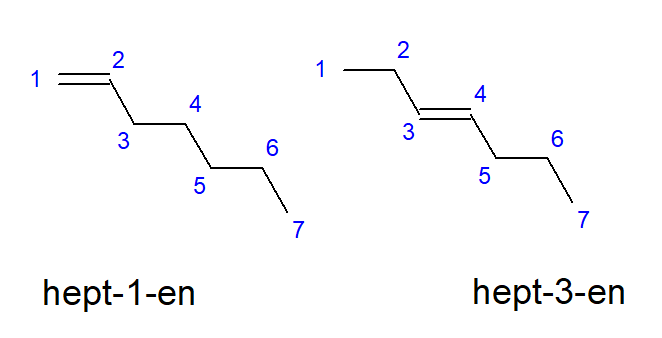
Abbildung 3 Strukturformeln von Hept-1-en (1-Hepten) und Hept-3-en (3-Hepten)
Zusammenfassung der Strukturen von Alkenen
Jedes Alken hat eine Doppelbindung pi (π), an der sich flache Strukturen bilden. Die Kohlenstoffatome weisen eine Hybridisierung sp2 auf, die durch eine trigonale Struktur gekennzeichnet ist. An gesättigten Stellen können die Methylengruppen –CH2– räumlich ausgebaute unverzweigte und verzweigte Ketten bilden. Eine Rotation findet nur um Einfachbindungen statt, nicht aber bei einer Bindung C=C.
Grundlegende physikalisch-chemische Eigenschaften der Gruppe der Alkene
Alkene haben hydrophobe Eigenschaften und sind daher von Natur aus unpolar. Sie reagieren mit Wasser. Aufgrund ihrer Affinität lösen sie sich gut in unpolaren Lösungsmitteln wie Alkanen. Der Schmelzpunkt, der Siedepunkt und die Dichte von Alkenen steigen mit zunehmender Anzahl der Kohlenstoffatome im Molekül. Im Gegensatz dazu verhält sich ihre Aktivität – die höchste Aktivität weisen Alkene mit kurzen Kohlenstoffketten auf.
Gewinnung von Alkenen
Es gibt mehrere Wege zur Gewinnung von Alkenverbindungen. Grundlage ist jeweils die Eliminierungsreaktion von zwei Substituenten an einer Einfachbindung, wie im Schema dargestellt:
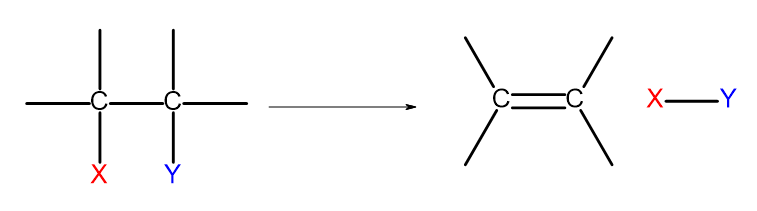
Abbildung 4Schematische Darstellung des Eliminierungsprozesses, der zur Bildung eines Alkens führt.
Allgemein sind dies die Reaktionen der Dehydrierung von Alkanen, die Dehydratation von Alkoholen, die Reaktion eines Halogenalkans mit einer starken Base, die Reaktion eines Dihalogenalkans mit Zinkstaub und die Hydrierung eines Alkins.
Gewinnung von Ethen
1. Dehydrierung von Alkan
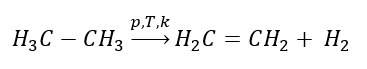
2. Dehydratation (Entwässerung) von Alkohol
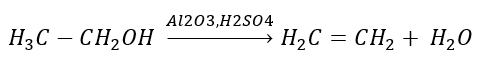
3. Reaktion eines Halogenalkans mit einer starken Base
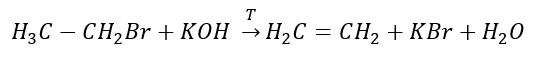
4. Reaktion eines Dihalogenalkans mit Zinkstaub
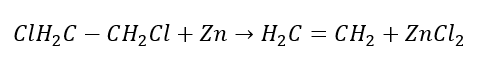
5. Hydrierung eines Alkins
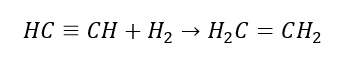
Chemische Reaktionen von Alkenen
Eine funktionelle Gruppe ist ein charakteristisches Fragment eines Moleküls, das für uns gleichzeitig seine Zugehörigkeit und seine Eigenschaften definiert. Bei Alkenen ist eine solche Gruppe die Doppelbindung C=C. Die darin enthaltene Bindung pi (π) ist sehr bruchanfällig. Die Elektronen, die das pi-Orbital besetzen, sind im Vergleich zu den Elektronen der sigma-Bindung weiter von den Kohlenstoffatomen entfernt und daher schwächer an diese gebunden. Dies führt zu ihrer größeren Mobilität und ihrer besseren Zugänglichkeit für sich nähernde Reaktanten, was die Bindung chemisch sehr reaktiv macht. Es gibt mehrere Reaktionstypen, nach denen die Umwandlung von Alkenen erfolgt. Diese sind: elektrophile Addition, freiradikalische Addition, Oxidation und Reduktion, Polymerisation und Substitution an der Allylposition.
Elektrophile Addition
Aufgrund der Beschaffenheit der Elektronen der pi-Bindung sind die Faktoren, die sie angreifen, von Natur aus elektropositiv. Solche Moleküle sind elektrophile Reagenzien, die eine hohe Affinität zu Elektronen aufweisen. In den meisten Fällen handelt es sich dabei um ein Proton sauren Ursprungs, eine Elektronenlücke oder ein Molekül, das bei Annäherung an pi-Elektronen leicht polarisiert. Die Additions- also Bindungsreaktion folgt einem ionischen Mechanismus. Es ist ein zweistufiger Mechanismus, bei dem das sich zunächst nähernde elektrophile Reagenz die Elektronen der pi-Bindung unter Bildung einer Einfachbindung und der Bildung eines vorübergehenden Carbokations einfängt. Dieses hochreaktive Molekül greift schnell andere Reaktanten an, die die Fähigkeit haben, das Moleküle zu binden. Beispiele für solche Reaktionen sind Additionen von Chlor oder Brom an Alken. Die Wasserstoffaddition (Hydrierung) ist auch in einem Additionsmechanismus möglich, aber nicht mehr elektrophil.
Freiradikalische Additionsreaktionen
Viele der Reaktionen, die Alkene eingehen, sind mit der Markovnikov-Regel unvereinbar. Das liegt daran, dass ihr Mechanismus auf der Reaktion von Elektronen der pi-Bindung mit freien Radikalen beruht, bei der eine Bindung zwischen Kohlenstoff und dem angreifenden Molekül gebildet wird. Als Ergebnis solcher Umwandlungen entsteht ein neues freies Radikal, das am benachbarten Kohlenstoffatom ein ungepaartes Elektron hat.
Substitution an der Allylposition
Außer der Reaktion mit der Doppelbindung können Alkene auch auf ähnliche Weise wie Alkane mit benachbarten Alkylgruppen reagieren. Ein Beispiel für eine solche Reaktion wäre die Substitution eines Wasserstoffatoms durch ein Halogen an einem Atom, das dem Kohlenstoffatom der Doppelbindung benachbart ist. Eine solche Reaktion hat keine Auswirkungen auf den ungesättigten Teil der Struktur.
