Алкени — ненасичені вуглеводні, які, як і алкани, локальний гомологічний ряд. Однак, на користь від алканів, алкени мають один кратний зв'язок – подвійний – між атомами вуглецю. Решта є одинарними зв'язками, але навіть наявність одного кратного зв'язку в молекулі робить вуглеводень ненасиченою сполукою.

Будова алкенів
Зв’язок CC між атомами в насичених вуглеводнях причиною до того, що кожен з ними має sp 3 гібридизацію. В алкенах, які мають зв’язки C=C, відбувається sp 2 гібридизація. Ця властивість зумовлює структуру сполук із подвійними зв’язками тригональної форми. Його 3 сигма-зв’язки знаходяться в одній площині і звернені до кутів рівностороннього трикутника, центром якого є атом Карбону. Навпаки, пі-зв’язки є результатом перекриття негібридної p-орбіталі в напрямку, перпендикулярному до трикутника, який утворений з гібридних орбіталей та орбіталей подібної симетрії сусіднього атома. Найпростішою конструкцією групи і першою сполукою в гомологічному ряду алкенів є етен. Метан, сполука, яка є першою з алканів , не може утворювати кратний зв’язок.
Приклад будови алкену
Візьмемо найпростішу сполуку групи — етен і розглянемо її будівництво. Ми знаємо, що атоми вуглецю в молекулі етену мають sp2 – гібридизацію, тому плоска молекули. Кути між зв’язками в цій схемі дорівнюють 120 o . Чотири зв’язки між атомами вуглецю та водню, присутні в структурі CH, є сигма δ SP-s зв’язками з лобовим перекриттям. Між атомами вуглецю також соціальнося гомоядерні зв’язки. Один — CC δ sp-sp, а інший — CC π pp , який утворений з негібридних p-орбіталей.
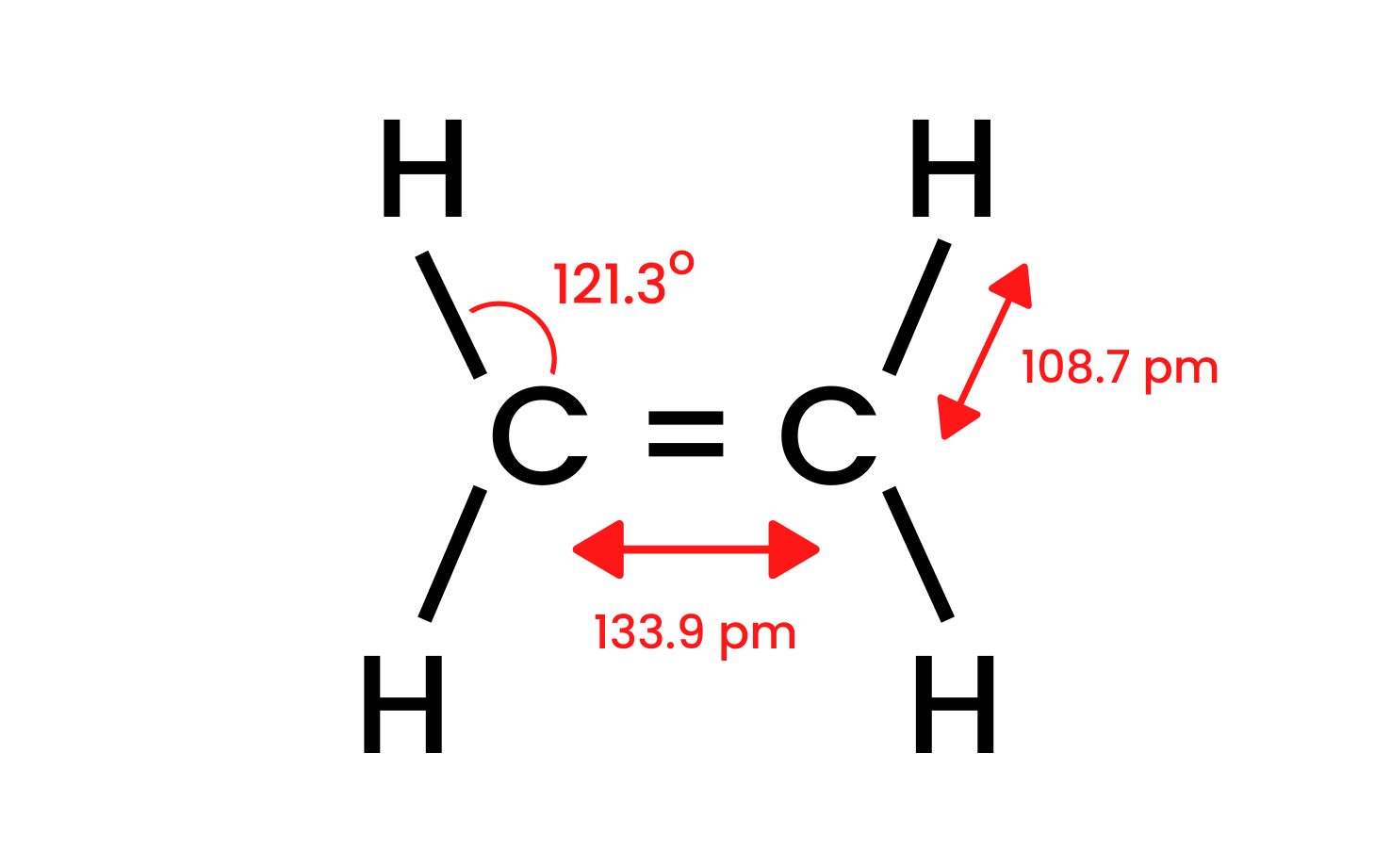
Рисунок 1. Структура етену
Гомологічний ряд алкенів
Гомологічний ряд — це група хімічних сполук, які мають дуже подібну хімічну структуру та властивості. такі речовини також можна записати спільною молекулярною формулою. Загальну формулу алкенів можна записати у вигляді C n H 2n . Конструктивно це виглядає так:
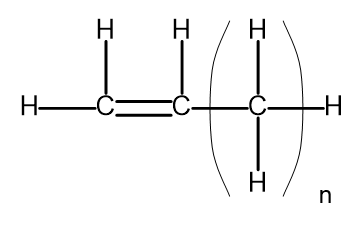
Рисунок 2. Загальна структурна формула алкенів
| Кількість атомів карбону в ланцюгу | Формула алкану | Назва алкану | Формула алкену | Назва алкена |
| 2 | C 2 H 6 | Етан | C 2 H 4 | Етен |
| 3 | C 3 H 8 | пропан | C 3 H 6 | Пропен |
| 4 | C 4 H 10 | Бутан | C 4 H 8 | Бутен |
| 5 | C 5 H 12 | Пентан | C 5 H 10 | Пентен |
| 6 | C 6 H 14 | Гексан | C 6 H 12 | Гексен |
| 7 | C 7 H 16 | Гептан | C 7 H 14 | Гептен |
| 8 | C 8 H 18 | Октан | C 8 H 16 | октен |
| 9 | C 9 H 20 | Nonane | C 9 H 18 | Жодного |
| 10 | C 10 H 22 | Декан | C 10 H 20 | Децен |
Сполуки від бутена до десяти можуть мати розгалуження в однакових розташуваннях атомів вуглецю, тому їх також можна назвати бут-1-ен, гепт-1-ен або дек-1-ен. Це означає, що між атомами вуглецю, які починають ланцюг, існує ненасичений зв’язок. Явище різноманітних можливостей ненасиченого кратного зв’язку називається позиційною ізомерією розміщення. Наприклад, сполука з молекулярною формулою C 7 H 14 має декілька можливих позиційних ізомерів. Подвійний зв’язок з його структурою може бути розташований, наприклад, на атомах вуглецю номер один і три, як показано на малюнку 3.
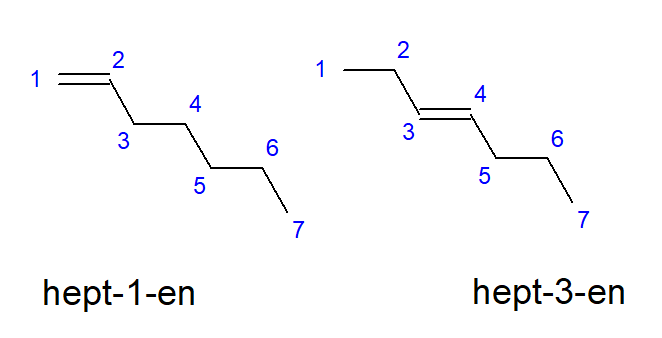
Рисунок 3. Структурні формули гепт-1-ену (1-гептена) та гепт-3-ену (3-гептена)
Будова алкенів – короткий зміст
Кожен алкен має подвійний пі-зв’язок (π), на якому створена плоска структура. Атоми вуглецю мають sp 2 гібридизацію, що характеризується тригональною формою. У насичених місцях метиленові групи –CH 2 – можуть створювати просторово розширені прямі та розгалужені ланцюги. Обертання відбувається лише навколо одинарних зв’язків і не відбувається у випадку зв’язку C=C. Основні фізико-хімічні властивості групи алкенів Алкени володіють гідрофобними властивостями, а тому мають неполярну природу. Вони вступають у реакцію з водою. Завдяки вашій спорідненості вони добре розчиняються в неполярних розчинниках, таких як алкани. Температура плавлення, температура кипіння і густина алкенів зростають із збільшенням кількості атомів вуглецю в молекулі. Найбільша їх активність у коротколанцюгових алкенів.
Отримання алкенів
Є декілька способів отримати алкенів. Кожен із цих шляхів базується на усуненні двох замісників в одному зв’язку, як показано на діаграмі:
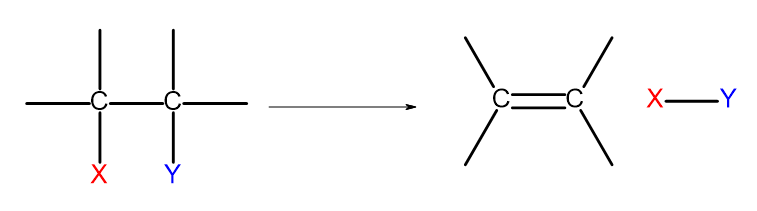
Рисунок 4. Схема процесу елімінування, в результаті якого утворюється алкен
Отримання етену
1. Дегідрування алкану 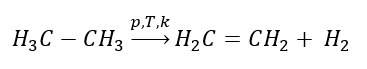 2. Зневоднення алкоголю
2. Зневоднення алкоголю 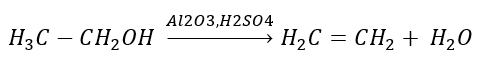 3. Реакція галоген-алкану з сильною основою
3. Реакція галоген-алкану з сильною основою 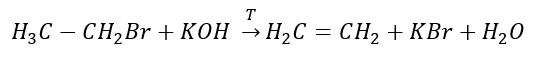 4. Реакція дигалогеналкану з цинковим пилом
4. Реакція дигалогеналкану з цинковим пилом 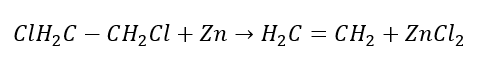 5. Гідрування алкіну
5. Гідрування алкіну 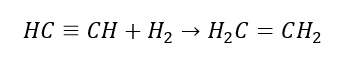
Хімічні реакції алкенів
Специфічний для частинки фрагмент, який одночасно використовує її властивості та приналежність, називається функціональною групою. Для алкенів ця група є подвійним зв’язком (С=С). Пі-зв’язок (π), який він містить, дуже сприйнятливий до розриву. Порівняно з електронними сигма-зв’язками, електрони, які менше займають пі-орбіталь, наведені далі від атомів вуглецю і тому пов’язані з ними. Це призводить до їх більшої рухливості та більшої доступності для наближення реагентів, що призводить до високої хімічної реакційної здатності зв’язку. Існує кілька типів реакцій, за якими відбувається перетворення алкенів. Це: електрофільне приєднання, вільнорадикальне приєднання, окислення та відновлення, полімеризація та алільне заміщення.
Електрофільне додавання
Через природу електронів пі-зв’язку агенти, які атакують їх, мають електропозитивний характер. такі молекули є електрофільними реагентами, які мають високу спорідненість до електронів. У майбутньому цим фактором є протон кислотного походження, електронний проміжок або молекула, яка легко поляризується внаслідок кількості до пі-електронів. Приєднання, тобто реакція з’єднання, відбувається за іонним механізмом. Цей двоетапний механізм, за допомогою якого електрофільний реагент, що спочатку наближається, захоплює електронну пі-зв’язку з утворенням одинарного зв’язку та утворенням тимчасового карбокатиону. Ця високореактивна молекула швидко атакує інші реагенти, які мають здатність об’єднувати електрони. Прикладами таких реакцій є приєднання хлору або брому до алкену. Водень також можна додавати (гідрування) шляхом приєднання, але він не є електрофільним.
Реакції вільнорадикального приєднання
Багато реакцій алкенів показують невідповідність правилу Марковнікова. Їх механізм зосередження на реакцію електронів пі-зв’язку на вільні радикали, під час якого утворюється зв’язок частинок, що атакує вуглець. В результаті цих змін утворюється новий вільний радикал, який має неспарений електрон у сусідньому атомі вуглецю.
Аллільне заміщення
одну реакцію за участю подвійного зв’язку, алкени також можуть реагувати у спосіб, подібний до реакції алканів у сусідніх алкільних групах. Прикладом такої реакції є заміщення атома Гідрогену галогеном біля атома, наступного за атомом Карбону, який утворює подвійний зв’язок. Ця реакція не впливає на ненасичену частину структури.

