Alkener är omättade kolväten, som liksom alkaner bildar en homolog serie. Men till skillnad från alkaner har alkener en multipelbindning - en dubbelbindning - mellan kolatomer. De återstående är enkelbindningar, men förekomsten av ens en multipelbindning i en molekyl gör kolvätet till en omättad förening.

Strukturen av alkener
CC-bindningen mellan atomer i mättade kolväten gör att var och en av dem har en sp 3 -hybridisering. I alkener, som har C=C-bindningar, sker en sp 2 -hybridisering. Denna egenskap gör att strukturen hos föreningar med dubbelbindningar är en trigonal form. Dess 3 sigma-bindningar är i samma plan och vetter mot hörnen av den liksidiga triangeln, vars centrum är kolatomen. Däremot resulterar pi-bindningar från överlappningen av en icke-hybrid p-orbital i en riktning vinkelrät mot triangeln, som bildas av hybridorbitaler och orbitaler med liknande symmetri hos den angränsande atomen. Den enklaste konstruktionen av gruppen, och den första föreningen i den homologa alkenserien, är eten. Metan, en förening som är den första av alkanerna, kunde inte bilda en multipelbindning.
Ett exempel på alkenens struktur
Låt oss ta den enklaste föreningen i gruppen, eten, och undersöka dess struktur. Vi vet att kolatomerna i molekylen eten har en sp 2 hybridisering, så molekylen är platt. Vinklarna mellan bindningarna i denna layout är 120 o . De fyra bindningarna mellan kol- och väteatomerna som finns i strukturen CH är sigma δ SP-s- bindningar med en frontal överlappning. Det finns också homonukleära bindningar som bildas mellan kolatomerna. Den ena är CC δ sp-sp och den andra är CC π pp , som bildas av icke-hybrid p-orbitaler.
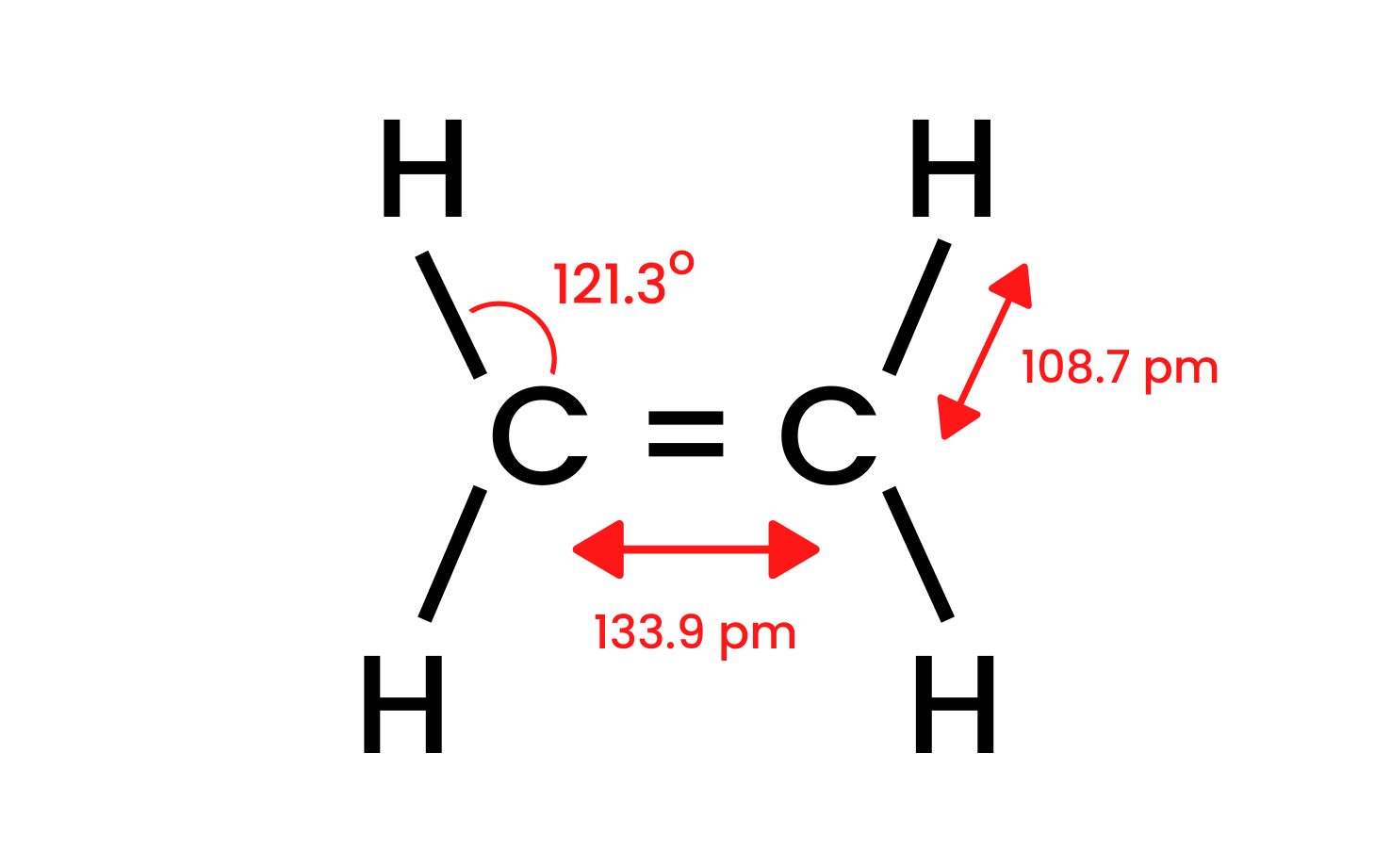
Figur 1. Strukturen för eten
Alken homolog serie
En homolog serie är en grupp kemiska föreningar som har en mycket liknande kemisk struktur och egenskaper. Sådana ämnen kan också skrivas med en vanlig molekylformel. Den allmänna formeln för alkener kan skrivas som C n H 2n . Strukturellt ser det ut så här:
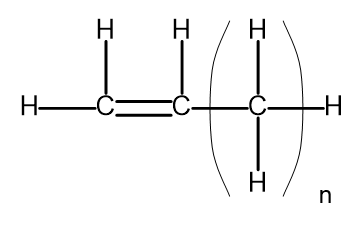
Figur 2. Allmän strukturformel för alkener
| Antal kolatomer i kedjan | Alkanformel | Alkannamn | Alkenformel | Alkennamn |
| 2 | C2H6 _ | Etan | C2H4 _ | Eten |
| 3 | C3H8 _ | Propan | C3H6 _ | Propen |
| 4 | C4H10 _ | Butan | C4H8 _ | Buten |
| 5 | C5H12 _ | Pentan | C5H10 _ | Pentene |
| 6 | C6H 14 | Hexan | C6H 12 | Hexen |
| 7 | C7H 16 | Heptan | C7H 14 | Hepten |
| 8 | C8H 18 | Oktan | C8H 16 | Okten |
| 9 | C9H20 _ | Ingen | C9H 18 | Nonene |
| 10 | C10H 22 | Decane | C10H20 _ | Decene |
Föreningarna från buten till decen kan ha grenar på lika platser av kolatomer, så de kan också kallas but-1-en, hept-1-en eller dec-1-en. Det betyder att den omättade bindningen finns mellan kolatomerna som startar kedjan. Fenomenet med de olika möjligheterna för placeringen av den omättade multipelbindningen kallas positionell isomerism. Till exempel har en förening med molekylformeln C7H14 flera möjliga positionsisomerer. Dubbelbindningen i sin struktur kan till exempel vara lokaliserad till kolatomerna nummer ett och tre, som visas i figur 3.
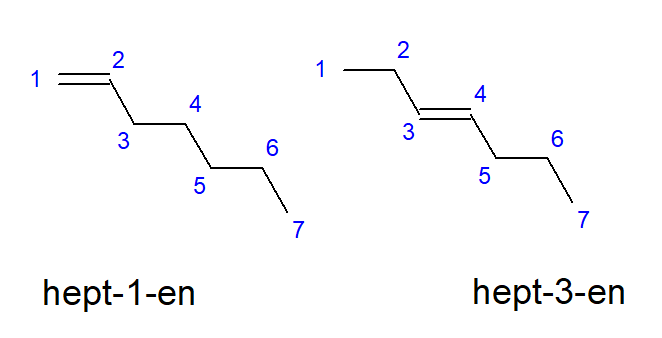
Figur 3. Strukturformler för hept-1-en (1-hepten) och hept-3-en (3-hepten)
Struktur av alkener – sammanfattning
Varje alken har en dubbel pi-bindning (π) vid vilken platta strukturer skapas. Kolatomer har en sp 2 hybridisering, kännetecknad av en trigonal form. På mättade platser kan -CH 2 – metylengrupperna skapa rumsligt expanderade raka och grenade kedjor. Rotation sker endast runt enkelbindningarna och sker inte i fallet med C=C-bindningen. De grundläggande fysikaliska och kemiska egenskaperna hos gruppen alkener Alkener har hydrofoba egenskaper och har därför en opolär natur. De går in i reaktioner med vatten. På grund av sin affinitet löser de sig väl i opolära lösningsmedel som alkaner. Smältpunkten, kokpunkten och densiteten hos alkenerna ökar när antalet kolatomer i molekylen ökar. Deras aktivitet är den största inom kortkedjiga alkener.
Erhållande av alkener
Det finns flera sätt att få fram alkener. Var och en av dessa sätt är baserad på eliminering av två substituenter vid en enkelbindning, som visas i diagrammet:
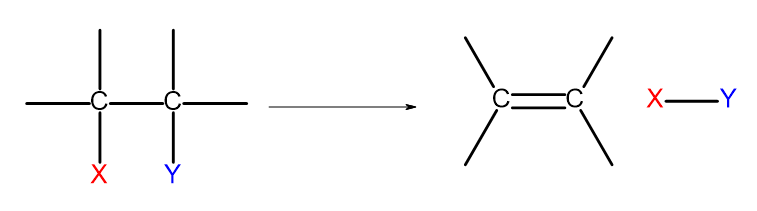
Figur 4. Diagrammet över elimineringsprocessen som resulterar i bildandet av en alken
Erhållande av eten
1. Dehydrering av en alkan 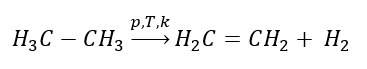 2. Uttorkning av en alkohol
2. Uttorkning av en alkohol 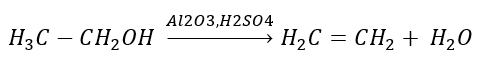 3. Reaktionen av en halogen-alkan med en stark bas
3. Reaktionen av en halogen-alkan med en stark bas 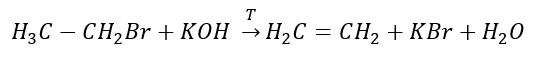 4. Reaktionen av en dihalogen-alkan med zinkdamm
4. Reaktionen av en dihalogen-alkan med zinkdamm 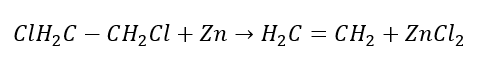 5. Hydrering av en alkyn
5. Hydrering av en alkyn 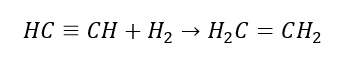
Kemiska reaktioner av alkener
Ett partikelspecifikt fragment, som samtidigt definierar sina egenskaper och tillhörighet, kallas en funktionell grupp. För alkener är denna grupp en dubbelbindning (C=C). Pi-bindningen (π) som den innehåller är mycket känslig för att brytas. Jämfört med elektroner i sigmabindningarna är elektroner som upptar pi-orbitalen längre bort från kolatomerna och är därför mindre associerade med dem. Detta resulterar i deras större rörlighet och större tillgänglighet för närmande reagens, vilket resulterar i en hög kemisk reaktivitet hos bindningen. Det finns flera typer av reaktioner enligt vilka alkenerna omvandlas. Dessa är: elektrofil addition, friradikaladdition, oxidation och reduktion, polymerisation och allylsubstitution.
Elektrofil addition
På grund av naturen hos elektroner i pi-bindningen har de medel som angriper dem en elektropositiv karaktär. Sådana molekyler är elektrofila reagens som har hög affinitet för elektroner. I de flesta fall är denna faktor en proton av surt ursprung, ett elektrongap eller en molekyl som lätt polariseras till följd av att den är nära pi-elektroner. Tillsatsen, dvs kopplingsreaktionen, följer jonmekanismen. Detta är en tvåstegsmekanism där ett initialt närmande elektrofilt reagens fångar elektronerna i pi-bindningen med skapandet av en enkelbindning och bildandet av en transient karbokatjon. Denna mycket reaktiva molekyl attackerar snabbt andra reagenser som har förmågan att mutualisera elektroner. Exempel på sådana reaktioner är tillsatser av klor eller brom till en alken. Väte kan också tillsättas (hydrering) genom tillsats, men det är inte elektrofilt.
Friradikaladditionsreaktioner
Många reaktioner av alkener visar bristande efterlevnad av Markovnikovs regel. Deras mekanism fokuserar på reaktionen av elektroner i pi-bindningen till fria radikaler, under vilken en kolanfallande partikelbindning produceras. Som ett resultat av dessa förändringar erhålls en ny fri radikal, som har en oparad elektron vid den angränsande kolatomen.
Allylisk substitution
Förutom reaktionen som involverar dubbelbindningen, kan alkener också reagera på ett sätt som liknar det för alkaner i angränsande alkylgrupper. Ett exempel på en sådan reaktion är att en väteatom ersätts med halogen vid atomen bredvid kolatomen som bildar dubbelbindningen. Denna reaktion påverkar inte den omättade delen av strukturen.

