Alkenler, alkanlar gibi homolog bir dizi oluşturan doymamış hidrokarbonlardır. Bununla birlikte, alkanlardan farklı olarak, alkenlerin karbon atomları arasında bir çoklu bağı - bir çift bağı - vardır. Geri kalanlar tekli bağlardır, ancak bir molekülde bir çoklu bağın oluşması bile hidrokarbonu doymamış bir bileşik yapar.

alkenlerin yapısı
Doymuş hidrokarbonlardaki atomlar arasındaki CC bağı, bunların her birinin bir sp3 hibridizasyonuna sahip olmasına neden olur. C = C bağına sahip alkenlerde sp2 hibritleşmesi olur. Bu özellik çift bağlı bileşiklerin yapısının trigonal formda olmasına neden olur. 3 sigma bağları aynı düzlemdedir ve merkezi karbon atomu olan eşkenar üçgenin köşelerine bakar. Buna karşılık, pi bağları, hibrit olmayan bir p orbitalinin, komşu atomun benzer simetriye sahip hibrit orbitallerinden ve orbitallerinden oluşan üçgene dik bir yönde üst üste binmesinden kaynaklanır. Grubun en basit yapısı ve alken homolog serilerindeki ilk bileşik etendir. Alkanların ilki olan bir bileşik olan metan çoklu bağ oluşturamaz.
Alken yapısına bir örnek
Grubun en basit bileşiği olan eteni ele alalım ve yapısını inceleyelim. Eten molekülündeki karbon atomlarının sp 2 hibritleşmesine sahip olduğunu biliyoruz, bu nedenle molekül düzdür. Bu düzende bağlar arasındaki açılar 120 o’dir . CH yapısında bulunan karbon ve hidrojen atomları arasındaki dört bağ, kafa kafaya örtüşen sigma δ SP-s bağlarıdır. Karbon atomları arasında oluşan homonükleer bağlar da vardır. Biri CC δ sp-sp ve diğeri hibrit olmayan p orbitallerinden oluşan CC π pp’dir .
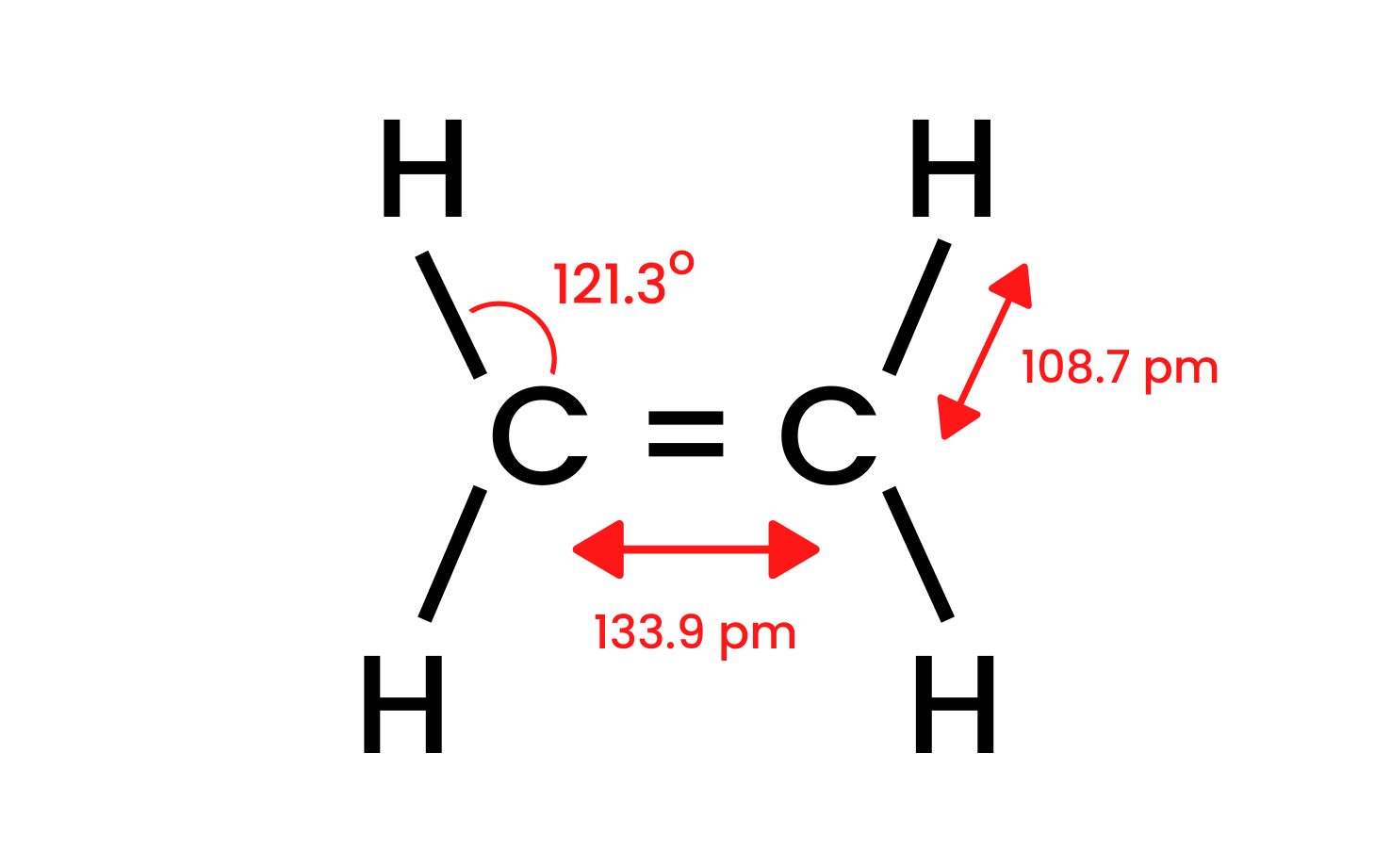
Şekil 1. Etanın yapısı
Alken homolog serisi
Bir homolog seri, çok benzer bir kimyasal yapıya ve özelliklere sahip bir kimyasal bileşikler grubudur. Bu tür maddeler ortak bir moleküler formülle de yazılabilir. Alkenler için genel formül CnH2n şeklinde yazılabilir . Yapısal olarak şuna benzer:
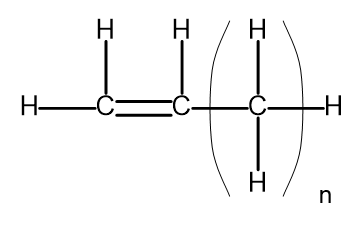
Şekil 2. Alkenler için genel yapısal formül
| Zincirdeki karbon atomu sayısı | alkan formülü | alkan adı | alken formülü | alken adı |
| 2 | C2H6 _ | Etan | C2H4 _ | etilen |
| 3 | C3H8 _ | Propan | C3H6 _ | propen |
| 4 | C4H10 _ | Bütan | C4H8 _ | büten |
| 5 | C5H12 _ | pentan | C5H10 _ | penten |
| 6 | C6H14 _ | heksan | C6H12 _ | Heksen |
| 7 | C 7 H 16 | heptan | C 7 H 14 | hepten |
| 8 | C8H18 _ | Oktan | C8H16 _ | okten |
| 9 | C9H20 _ | nonan | C9H18 _ | hiçbiri |
| 10 | C10H22 _ | Dekan | C 10 H 20 | Decene |
Bütenden dekene kadar olan bileşikler, karbon atomlarının eşit konumlarında dallara sahip olabilir, bu nedenle bunlar aynı zamanda but-1-en, hept-1-en veya dec-1-en olarak da adlandırılabilir. Bu, zinciri başlatan karbon atomları arasında doymamış bağ olduğu anlamına gelir. Doymamış çoklu bağın yerleştirilmesinin çeşitli olasılıkları olgusuna konumsal izomerizm denir. Örneğin, C7H14 moleküler formülüne sahip bir bileşik, birkaç olası konum izomerine sahiptir. Yapısındaki çift bağ, örneğin Şekil 3’te gösterildiği gibi bir ve üç numaralı karbon atomlarında bulunabilir.
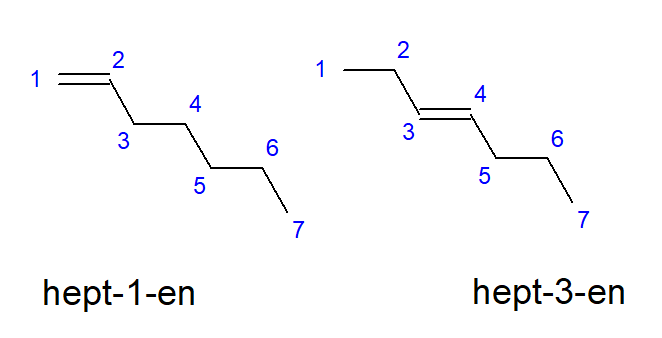
Şekil 3. Hept-1-ene (1-hepten) ve hept-3-ene (3-hepten)’in yapısal formülleri
Alkenlerin yapısı – özet
Her alken, düz yapıların oluşturulduğu bir çift pi bağına (π) sahiptir. Karbon atomları, trigonal bir formla karakterize edilen bir sp2 hibridizasyonuna sahiptir . Doymuş yerlerde, –CH2 – metilen grupları uzamsal olarak genişlemiş düz ve dallanmış zincirler oluşturabilir. Dönme yalnızca tekli bağların etrafında gerçekleşir ve C=C bağı durumunda oluşmaz. Alken grubunun temel fiziksel ve kimyasal özellikleri Alkenler hidrofobik özelliklere sahiptir ve bu nedenle polar olmayan bir yapıya sahiptir. Su ile reaksiyona girerler. Afiniteleri nedeniyle alkanlar gibi polar olmayan çözücülerde iyi çözünürler. Moleküldeki karbon sayısı arttıkça alkenlerin erime noktası, kaynama noktası ve yoğunluğu artar. Kısa zincirli alkenlerin aktiviteleri en büyüğüdür.
alkenlerin elde edilmesi
Alken elde etmenin birkaç yolu vardır. Bu yolların her biri, şemada gösterildiği gibi, tek bir bağda iki ikame edicinin ortadan kaldırılmasına dayanır:
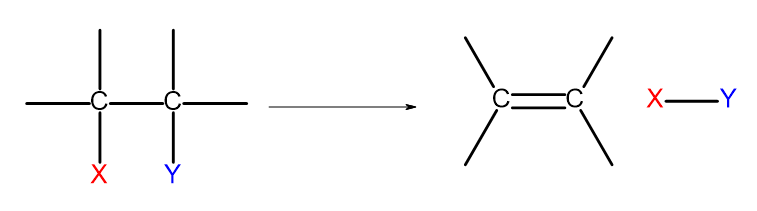
Şekil 4. Bir alken oluşumuyla sonuçlanan eliminasyon işleminin diyagramı
eten elde edilmesi
1. Bir alkanın dehidrojenasyonu 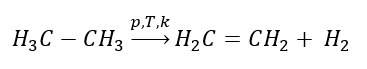 2. Bir alkolün dehidrasyonu
2. Bir alkolün dehidrasyonu 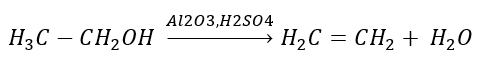 3. Bir halojen-alkanın güçlü bir baz ile reaksiyonu
3. Bir halojen-alkanın güçlü bir baz ile reaksiyonu 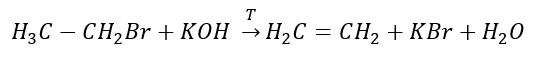 4. Bir dihalojen-alkanın çinko tozu ile reaksiyonu
4. Bir dihalojen-alkanın çinko tozu ile reaksiyonu 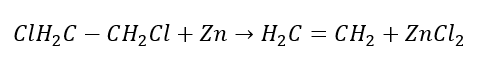 5. Bir alkinin hidrojenasyonu
5. Bir alkinin hidrojenasyonu 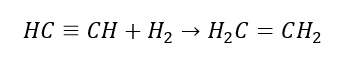
Alkenlerin kimyasal reaksiyonları
Aynı zamanda özelliklerini ve ilişkisini tanımlayan parçacığa özgü bir parçaya fonksiyonel grup denir. Alkenler için bu grup bir çift bağdır (C=C). İçerdiği pi bağı (π) kırılmaya karşı çok hassastır. Sigma bağlarının elektronlarıyla karşılaştırıldığında, pi orbitalini işgal eden elektronlar karbon atomlarından daha uzaktadır ve bu nedenle onlarla daha az ilişkilidir. Bu, daha fazla hareketlilik ve yaklaşan reaktifler için daha fazla kullanılabilirlik ile sonuçlanarak bağın yüksek kimyasal reaktivitesine neden olur. Alkenlerin dönüştürüldüğü çeşitli reaksiyon türleri vardır. Bunlar: elektrofilik ekleme, serbest radikal ekleme, oksidasyon ve indirgeme, polimerizasyon ve alilik ikamesidir.
elektrofilik ekleme
Pi bağının elektronlarının doğası gereği onlara saldıran maddeler elektropozitif bir karaktere sahiptir. Bu tür moleküller, elektronlar için yüksek bir afiniteye sahip olan elektrofilik reaktiflerdir. Çoğu durumda, bu faktör asit kökenli bir proton, bir elektron boşluğu veya pi elektronlarına yakın olması sonucu kolayca polarize olan bir moleküldür. Ekleme, yani bağlantı reaksiyonu, iyon mekanizmasını takip eder. Bu, başlangıçta yaklaşan bir elektrofilik reaktifin, tek bir bağ ve geçici bir karbokatyon oluşumu ile pi bağının elektronlarını yakaladığı iki aşamalı bir mekanizmadır. Bu oldukça reaktif molekül, elektronları karşılıklı hale getirme yeteneğine sahip diğer reaktiflere hızla saldırır. Bu tür reaksiyonların örnekleri, bir alkene klorin veya bromin eklenmesidir. Hidrojen de ekleme yoluyla eklenebilir (hidrojenleştirme), ancak elektrofilik değildir.
Serbest radikal ekleme reaksiyonları
Alkenlerin birçok reaksiyonu, Markovnikov kuralına uymadığını gösterir. Mekanizmaları, pi bağının elektronlarının serbest radikallere tepkimesine odaklanır ve bu sırada bir karbon saldıran parçacık bağı üretilir. Bu değişikliklerin bir sonucu olarak, komşu karbon atomunda eşleşmemiş bir elektrona sahip olan yeni bir serbest radikal elde edilir.
alilik ikamesi
Alkenler, çift bağ içeren reaksiyona ek olarak, komşu alkil gruplarındaki alkanlarınkine benzer bir şekilde reaksiyona girebilirler. Böyle bir reaksiyonun bir örneği, çift bağı oluşturan karbon atomunun yanındaki atomda bir hidrojen atomunun halojen ile yer değiştirmesidir. Bu reaksiyon yapının doymamış kısmını etkilemez.

