Алкены — ненасыщенные углеводороды, образующие, как и алканы, гомологический ряд. В отличие от них, в молекулах алкенов имеется одна двойная связь между атомами углерода. Остальные - одинарные связи, но наличие даже одной множественной связи в молекуле делает углеводород ненасыщенным соединением.

Строение алкенов
Связь между атомами С-С в насыщенных углеводородах приводит к sp3-гибридизации каждого из них. В алкенах со связью С=С происходит sp2-гибридизация. Это свойство приводит к тому, что структура соединений с двойной связью принимает тригональную форму. 3 сигма-связи находятся в одной плоскости и направлены к углам равностороннего треугольника, центром которого является атом углерода. С другой стороны, пи-связь возникает в результате перекрывания негибридной р-орбитали, лежащей в направлении, перпендикулярном треугольнику, который составлен из гибридных орбиталей и орбиталей с аналогичной симметрией соседнего атома. Простейшим представителем алкенов и первым членом гомологического ряда является этен. Метан, являющийся соединением, представляющий алканы, не может образовывать множественную связь.
Пример строения алкена
Принимая во внимание самое простое соединение группы – этен, можно представить модель строения. Мы знаем, что атомы углерода в молекуле этена подвергаются sp2-гибридизации, и поэтому молекула плоская. Углы в такой системе между связями равны 120o. Присутствующие в структуре четыре связи между атомами углерода и водорода C-H представляют собой фронтальные сигма-связи δsp-s. Также видны гомоядерные связи, образующиеся между атомами углерода. Одна связь C-C тип δsp-sp и другая C-C тип πp-p, которые возникают из негибридных p-орбиталей.
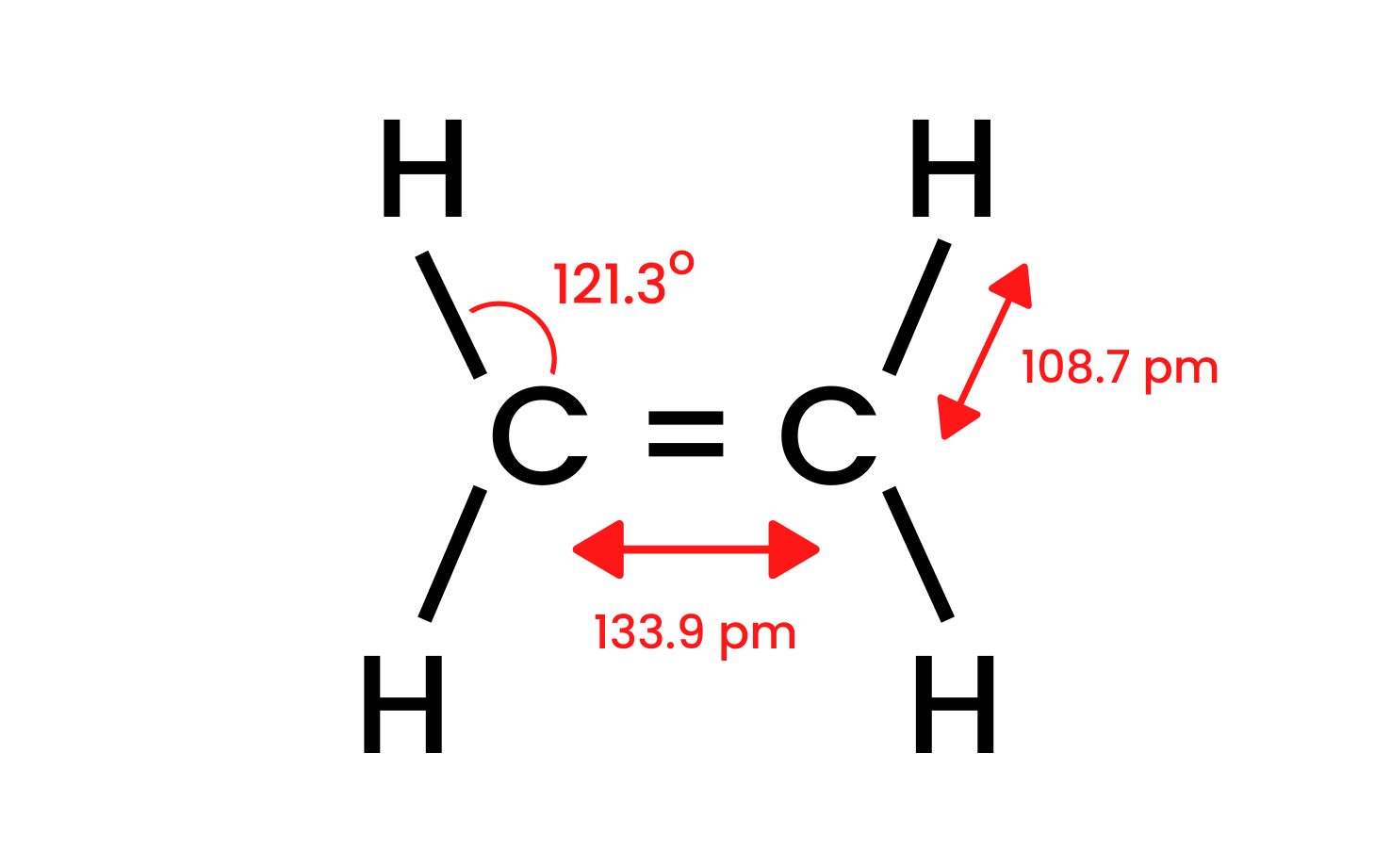
Рисунок 1 Строение этена.
Гомологический ряд алкенов
Гомологический ряд – это набор химических соединений, которые характеризуются очень сходным химическим строением и свойствами. Мы также можем записать такие вещества общей формулой.
Общая формула алкенов может быть записана как CnH2n. Структурно, это выглядит следующим образом:
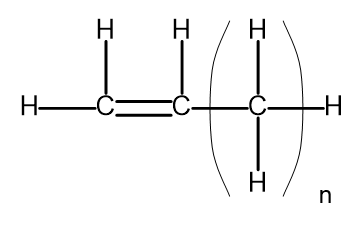
Рисунок 2 Общая формула алкенов.
Как и насыщенные углеводороды, алкены также образуют свой гомологичный ряд, который начинается с этена и заканчивается декеном. Название алкена происходит от названия аналогичного ему алкана с таким же числом атомов углерода в молекуле. Разница заключается в используемом окончании: -ан для алканов и -ен для алкенов, например, пентан-пентен.
| Число атомов углерода, присутствующих в цепи | Формула алкана | Название алкана | Формула алкена | Название алкена |
| 2 | C2H6 | Этан | C2H4 | Этен |
| 3 | C3H8 | Пропан | C3H6 | Пропен |
| 4 | C4H10 | Бутан | C4H8 | Бутен |
| 5 | C5H12 | Пентан | C5H10 | Пентен |
| 6 | C6H14 | Гексан | C6H12 | Гексен |
| 7 | C7H16 | Гептан | C7H14 | Гептен |
| 8 | C8H18 | Октан | C8H16 | Октен |
| 9 | C9H20 | Нонан | C9H18 | Нонен |
| 10 | C10H22 | Декан | C10H20 | Децен |
Соединения, от бутена до децена, могут иметь разветвления при равном расположении атомов углерода, поэтому иначе их можно назвать бут-1-ен, гепт-1-ен или дец-1-ен. Это означает, что ненасыщенная связь находится между атомами углерода, с которых начинается цепь. Явление различных возможностей расположения ненасыщенной множественной связи называется позиционной изомерией. Например, соединение с общей формулой C7H14 имеет несколько возможных позиционных изомеров. Двойная связь, находящаяся в его структуре, может быть локализована, например, с атомами углерода номер один и три, как показано на Рисунке 3.
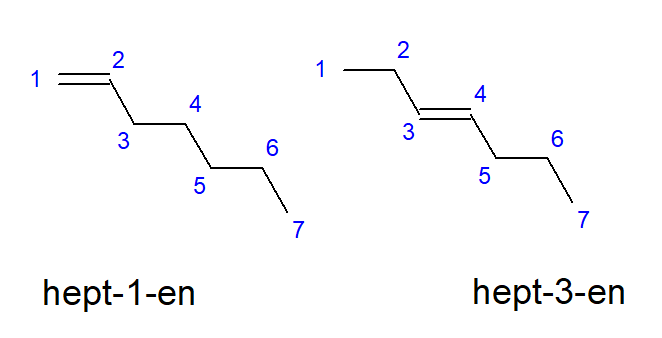
Рисунок 3 Структурные формулы гепт-1-ена (1-гептен) и гепт-3-ена (3-гептен)
Подведение итогов о структуре алкенов
Каждый алкен имеет двойную пи-связь (π), при которой образуются плоские структуры. Атомы углерода обладают sp2-гибридизацией, характеризующейся тригональной структурой. В насыщенных местах метиленовые группы –CH2— могут образовывать длинные прямые и разветвленные цепи. Вращение происходит только вокруг одинарных связей, оно не происходит в случае связи C=C.
Основные физико-химические свойства группы алкенов
Алкены гидрофобны и поэтому неполярны. Вступают в реакцию с водой. Благодаря своему сродству они хорошо растворяются в неполярных растворителях, таких как алканы. Температура плавления, температура кипения и плотность алкенов увеличиваются по мере увеличения числа атомов углерода в молекуле. Наоборот проявляет себя их активность – наибольшую активность характеризуют алкены с короткими углеродными цепями.
Получение алкенов
Существует несколько способов получения алкеновых соединений. В основе каждого из них лежит реакция элиминации двух заместителей при одинарной связи по схеме:
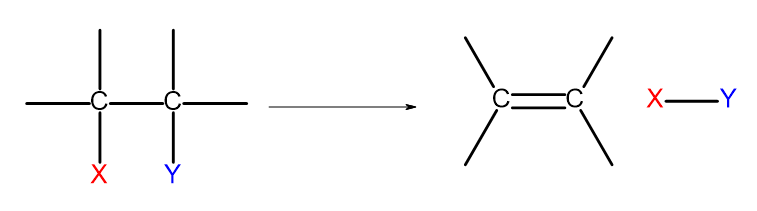
Рисунок 4 Схема процесса элиминации, приводящего к образованию алкена.
Как правило, это реакции дегидрирования алкана, дегидратации спирта, реакция галогеналкана с сильным основанием, реакция дигалогеналкана с цинковой пылью, гидрирование алкина.
Получение этена
1. Дегидрирование алкана
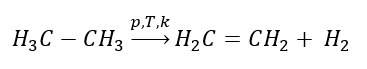
2. Дегидратация (обезвоживание) спирта
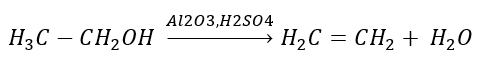
3. Реакция галогеналкана с сильным основанием
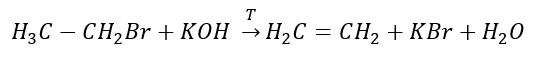
4. Реакция дигалогеналкана с цинковой пылью
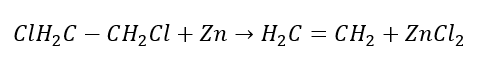
5. Гидрирование алкина
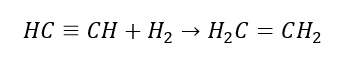
Химические реакции алкенов
Функциональная группа – это фрагмент, характерный для молекулы, который одновременно определяет ее принадлежность и свойства. Для алкенов такой группой является двойная связь C=C. Содержащаяся в нем пи-связь (π) очень подвержена разрыву. Электроны, занимающие пи-орбиталь, находятся дальше от атомов углерода по сравнению с электронами сигма-связей и, следовательно, менее связаны с ними. Это приводит к их большей подвижности и большей доступности для приближающихся реагентов, благодаря чему связь проявляет высокую химическую активность. Существует несколько типов реакций, в которых происходят превращения алкенов. К ним относятся: электрофильное присоединение, свободнорадикальное присоединение, окислительно-восстановительные реакции, полимеризация и аллильное замещение.
Электрофильное присоединение
Из-за природы электронов пи-связей, факторы, которые их атакуют, являются электроположительными. Такие молекулы являются электрофильными реагентами с высоким сродством к электронам. В большинстве случаев таким фактором является кислотный протон, электронная щель или молекула, которая легко поляризуется при приближении к пи-электронам. Реакция присоединения протекает по ионному механизму. Это двухэтапный механизм, при котором первоначально приближающийся электрофильный реагент захватывает электроны пи-связи с образованием одинарной связи и образованием промежуточного карбокатиона. Эта высокореактивная молекула быстро атакует другие реагенты, способные делиться электронами. Примерами таких реакций являются присоединения к алкену хлора, брома. Также возможно присоединение водорода (гидрогенизация) по механизму присоединения, однако уже не электрофильное.
Реакции радикального присоединения
Многие реакции, которым подвергаются алкены, показывают несоответствие правилу Марковникова. Их механизм основан на реакции электронов пи-связи со свободными радикалами, в ходе которой образуется связь углерод-атакующая частица. В результате таких превращений получается новый свободный радикал, имеющий неспаренный электрон у соседнего атома углерода.
Аллильное замещение
В дополнение к реакциям с двойной связью алкены также могут реагировать аналогично алканам в соседних алкильных группах. Примером такой реакции может быть замещение атома водорода галогеном с атомом, соседствующим с атомом углерода двойной связи. Такая реакция не влияет на ненасыщенную часть структуры.
