Wśród organicznych związków chemicznych, zaliczanych do nienasyconych węglowodorów, możemy wyróżnić grupę o nazwie Alkiny. Przynależność do tej rodziny związków zawdzięczają swojej budowie – cząsteczka zawiera jedynie atomy węgla i wodoru, a jedno z wiązań pomiędzy węglami jest nienasycone. W przypadku alkinów jest to wiązanie potrójne C≡C. Wielu przedstawicieli grupy możemy znaleźć w produktach codziennego użytku, na przykład w benzynie, atramencie, pestycydach, ale również w kosmetykach, gdzie pełnią rolę antyoksydantów.

Budowa alkinów
Wzór ogólny alkinów to CnH2n-2, a każdy z nich zawiera minimum jedno wiązanie potrójne. Strukturalnie, stanowią izomery dienów, cykloalkenów oraz cykloalkenów dwupierścieniowych. Alkiny, podobnie jak alkany czy alkeny, posiadają budowę łańcuchową, prostą lub rozgałęzioną. Oprócz wiązania potrójnego, które jest wiązaniem kowalencyjnym, występują jedynie inne, pojedyncze, ale również kowalencyjne wiązania pomiędzy atomami węgla C-C oraz atomami węgla i wodoru C-H. Wiązanie potrójne powstanie jedynie w przypadku, kiedy dwa kolejne atomy węgla przestrzennie znajdują się w liniowej hybrydyzacji sp. Długość tego wiązania to około 0,120 nm. Dla przykładu, w etynie jedna hybryda węgla łączy się z orbitalem atomu wodoru, wytwarzając wiązanie kowalencyjne typu sigma sp-s (δsp-s). Druga natomiast łączy się analogicznym wiązaniem sigma sp-sp (δsp-sp), z wytworzeniem kolejnej hybrydy łączącej się z atomem wodoru. Takie przemiany skutkują powstaniem liniowego szkieletu cząsteczki. Ze względu na powstającą hybrydyzację sp, obecne są również dwa, prostopadłe do osi wiązania, orbitale p, z których docelowo wytwarzają się dwa wiązania π pomiędzy atomami węgla. Dookoła wiązania potrójnego nie obserwuje się rotacji.
Nazewnictwo alkinów
Istnieje kilka podstawowych zasad, którymi należy się kierować podczas nazywania tych związków chemicznych:
- Sama obecność nienasyconego, potrójnego wiązania w strukturze zaznaczana jest w postaci końcówki „-yn” lub „-in” po spółgłoskach ch, f, g, k, l, wymieniającej końcówkę „-an” w nazwie odpowiedniego homologu – alkanu. W przypadku, kiedy możliwych jest kilka lokacji takiego wiązania, zawsze końcówkę „-yn” poprzedza odpowiednia liczba, oznaczająca lokant wiązania, na przykład hept-2-yn lub hept-1-yn. Lokant można stosować również na początku nazwy, na przykład 1-butyn.
- W przypadku struktur, zawierających więcej niż jedno wiązanie potrójne, do końcówki dodaje się jeszcze przedrostek, oznaczający ich ilość. Mogą być to odpowiednio –di, -tri itp.
- Numeracja atomów węgla musi przybierać taki kierunek, aby łańcuch główny zawierał możliwie najwięcej atomów węgla oraz wiązanie potrójne.
- W przypadku, jeśli jedynym wiązaniem nienasyconym jest wiązanie potrójne – atomy węgla numeruje się tak, aby miało ono jak najniższy lokant. Zasada nie obowiązuje, jeżeli występują jeszcze inne wiązania nienasycone – podwójne. Wtedy to ich lokanty muszą być możliwie najniższe.
- W nazwie związku o jednym wiązaniu potrójnym, znajdującym się przy lokancie pierwszym, cyfrę można pominąć, to znaczy, możemy stosować nazwę prop-1-yn, ale również propyn.
Właściwości fizykochemiczne alkinów
Charakter alkinów jest niepolarny, są hydrofobowe oraz wykazują reakcje z wodą. Najlepiej, rozpuszczają się w podobnych sobie rozpuszczalnikach niepolarnych, takich jak alkany. Wraz ze zwiększającym się łańcuchem węglowym, wzrasta ich temperatura topnienia, temperatura wrzenia oraz gęstość. Maleje jednak w tym samym czasie ich aktywność. Najbardziej reaktywne są te o niskich ilościach atomów węgla, znajdujących się w łańcuchu. W porównaniu z alkanami i alkenami są nieco bardziej reaktywne, ze względu na mniejszą stabilność wiązania potrójnego w porównaniu do pojedynczego lub podwójnego. Z ich struktury molekularnej, wynika również wysoka łatwopalność tych związków. Jedną z charakterystycznych reakcji, którym ulegają alkiny jest reakcja spalania. Są zdolne do addycji odczynnika elektrofilowego w miejscu nienasyconego wiązania. Ulegają reakcji polimeryzacji.
Szereg homologiczny alkinów
Podobnie jak alkany oraz alkeny, alkiny również posiadają swój szereg homologiczny, czyli swoją hierarchię związków podstawowych, zawierających dokładnie jedno wiązanie potrójne, uszeregowanych zgodnie ze wzrastającą liczbą atomów węgla w strukturze. Związkiem, rozpoczynającym szereg homologiczny alkinów jest etyn, inaczej nazywany acetylenem, który posiada w swojej strukturze dwa atomy węgla oraz dwa atomy wodoru
| Liczba atomów węgla w łańcuchu | Wzór alkanu | Nazwa alkanu | Wzór alkinu | Nazwa alkinu |
| 2 | C2H6 | Etan | C2H2 | Etyn |
| 3 | C3H8 | Propan | C3H4 | Propyn |
| 4 | C4H10 | Butan | C4H6 | Butyn |
| 5 | C5H12 | Pentan | C5H8 | Pentyn |
| 6 | C6H14 | Heksan | C6H10 | Heksyn |
| 7 | C7H16 | Heptan | C7H12 | Heptyn |
| 8 | C8H18 | Oktan | C8H14 | Oktyn |
| 9 | C9H20 | Nonan | C9H16 | Nonyn |
| 10 | C10H22 | Dekan | C10H18 | Dekyn |
Otrzymywanie alkinów na przykładzie etynu
- Reakcja karbidu z wodą
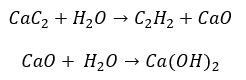
- Piroliza
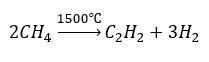
- Synteza z wykorzystaniem wysokich temperatur
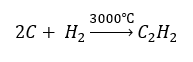
- Częściowe utlenienie gazu ziemnego
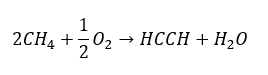
Wyższe alkiny, w skali przemysłowej otrzymuje się, stosując w roli reagenta etyn oraz, na przykład formaldehydu w reakcji kondensacji. Inną metodą jest dwukrotna eliminacja fluorowcowodoru z odpowiednich halogenków alkilowych, zawierających dwa atomy halogenu, przyłączone do jednego atomu węgla lub przy sąsiednich. W drugim przypadku, możliwe do powstania są dwa produkty – alkin oraz dien. Przykładowa reakcja powstawania propynu:
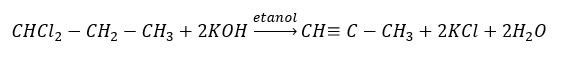
Charakterystyczne reakcje alkinów
- Spalanie całkowite z wytworzeniem dwutlenku węgla
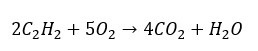
- Spalanie częściowe z wytworzeniem tlenku węgla lub sadzy
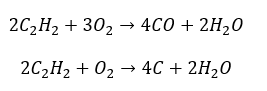
- Reakcja uwodornienia w obecności metalicznych katalizatorów Pd, Pt, Fe, Ni, w wyniku czego powstają alkeny. Może zachodzić etapowo, z dołączaniem kolejnych pojedynczych cząsteczek wodoru lub całkowicie, z wytworzeniem alkanu.
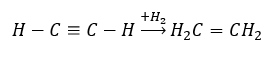
- Reakcja Kuczerowa, charakterystyczna dla alkinów, polegająca na addycji cząsteczki wody w okolicy wiązania potrójnego, która przebiega dwuetapowo. Początkowo, powstaje nietrwały enol, który jest połączeniem alkenu oraz alkoholu. Następnie ulega on tautomerii keto-enolowej, czyli przegrupowaniu z wytworzeniem aldehydów lub ketonów. Przemiana ulega według mechanizmu elektrofilowego.
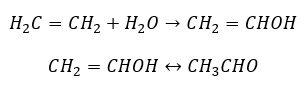
- Reakcja addycji elektrofilowej z HCl lub HBr, zachodząca zgodnie z regułą Markownikowa. Może zachodzić całkowicie lub wieloetapowo.
- Addycja elektrofilowa bromu, z wytworzeniem di- lub tetra- bromopochodnych. Ze względu na reakcje z bromem, alkiny odbarwiają wodę bromową. Analogicznie reagują również z cząsteczkami chloru.
- Wolnorodnikowa reakcja addycji fluorowców, przebiegająca pod wpływem energii świetlnej
- Reakcje substytucji, w wyniku których atom wodoru, znajdujący się przy atomie węglu wiązania potrójnego, wypierany jest przez atom metalu
- Trimeryzacja, czyli polimeryzacja z udziałem trzech cząsteczek, z wykorzystaniem acetylenu pozwoliła na syntezę benzenu.
