Mezi organické chemické sloučeniny, které jsou klasifikovány jako nenasycené uhlovodíky, můžeme rozlišit skupinu nazývanou alkyny. Do této skupiny sloučenin patří svou strukturu – molekula pouze atomy uhlíku a vodíku a jedna z vazeb mezi atomy uhlíku je nenasycená. U alkynů se jedná o trojnou vazbu C≡C. Mnoho zástupců skupiny najdeme v produktech každodenní potřeby, jako je benzín, inkoust, pesticidy, ale také v kosmetice, kde mají roli antioxidantů.

Struktura alkynů
Obecný vzorec pro alkyny je CnH2n-2 a každý obsahuje minimálně jednu trojnou vazbu. Strukturálně jsou to izomery dienů, cykloalkenů a dvoukruhových cykloalkenů. Alkyny, stejně jako alkany nebo alkeny, mají strukturu řetězce, která je buď přímá nebo rozvětvená. Kromě trojné vazby, která je vazbou kovalentní, existují pouze další jednoduché, ale také kovalentní vazby CC mezi atomy uhlíku a vazby CH mezi atomy uhlíku a vodíku. K trojné vazbě dojde pouze v případě, že dva po sobě jdoucí atomy uhlíku jsou prostorově umístěny v lineární sp hybridizaci. Délka této vazby je přibližně 0,120 nm. Například v ethynu se jeden uhlíkový hybrid spojí s orbitalem atomu vodíku za vzniku sp-s (δ sp-s ) kovalentní sigma vazby. Druhý se na druhé straně váží s analogickou sp-sp (δ sp-sp ) sigma vazbou, což vede k dalšímu hybridu spojujícímu se s atomem vodíku. Takové změny vedou k vytvoření lineárního rámce molekul. V důsledku výsledné sp hybridizace jsou také přítomny dva orbitaly p kolmé k ose vazby, ze kterých jsou nakonec vytvořeny dvě π vazby mezi atomy uhlíku. Kolem trojné vazby nedochází k žádné rotaci.
Alkyny – nomenklatura
Při pojmenovávání těchto chemických sloučenin je třeba dodržovat několik základních zásad:
- Přítomnost nenasycené trojné vazby ve struktuře je indikována příponou ‘-yne’ nahrazující příponu ‘-ane’ v příslušném homologu alkanu. V případě, že je několik umístění takové vazby, přípona ‘-yne’ vždy předchází příslušnému číslu označujícímu lokant vazby, jako je hept-2-yne nebo hept-1-yne. Lokant může být umístěn na začátku názvu, například 1-butyn.
- U struktur, které obsahují více než jednu trojnou vazbu, se k příponě přidá předpona, která označuje číslo. Budou to -di, -tri atd., v tomto pořadí.
- Číslování atomů uhlíku musí mít směr, ve kterém hlavní řetězec obsahuje co nejvíce atomů uhlíku a také trojnou vazbu.
- V případě, že jedinou nenasycenou vazbou je trojná vazba, atom uhlíku se očísluje tak, aby měl co nejnižší počet. Toto pravidlo neplatí, pokud existují další nenasycené dluhopisy (double), v takovém případě musí být jejich lokanty co nejnižší.
- V názvech sloučenin s jednou trojnou vazbou vedle prvního lokantu lze číslo vynechat, jinými slovy lze použít název prop-1-yne i název propin
Fyzikálně-chemické vlastnosti alkynů
Povaha alkynů je nepolární, jsou hydrofobní a reagují s vodou. Výhodně se rozpouštějí v podobných nepolárních rozpouštědlech, jako jsou alkany. Jak se uhlíkový řetězec prodlužuje, zvyšuje se jeho teplota tání, bod varu a hustota. Jejich aktivita však zároveň klesá. Nejreaktivnější jsou ty s nejmenším počtem atomů uhlíku v řetězci. Ve srovnání s alkany a alkeny jsou o něco reaktivnější, protože trojná vazba je menší než jednoduchá nebo dvojná vazba. Jejich molekulární struktura má také za následek vysokou hořlavost těchto sloučenin. Jednou z charakteristických reakcí alkynů je reakce spalování. Dokážou přidat elektrofilní činidlo v místě nenasycené vazby. Podléhají polymeračním reakcím.
Alkynová homologická řada
Stejně jako alkany a alkeny mají i alkyny svou homologickou řadu, tj. hierarchii základních sloučenin, které obsahují právě jednu trojnou vazbu klasifikovanou podle rostoucího počtu atomů uhlíku ve struktuře. Sloučenina, která začíná alkynovou homologickou řadu, je ethyn, také nazývaný acetylen, který má ve své struktuře dva atomy uhlíku a dva atomy vodíku.
| Počet atomů uhlíku v řetězci | Alkanový vzorec | Alkanové jméno | Alkynový vzorec | Jméno Alkyne |
| 2 | C2H6 _ | Etan | C2H2 _ | Ethyne |
| 3 | C3H8 _ | propan | C3H4 _ | Propyne |
| 4 | C4H10 _ | butan | C4H6 _ | Butyne |
| 5 | C5H12 _ | pentan | C5H8 _ | Pentyne |
| 6 | C6H14 _ | Hexan | C6H10 _ | Hexyne |
| 7 | C7H16 _ | Heptan | C7H12 _ | Heptyne |
| 8 | C 8H 18 | Oktan | C8H14 _ | Octyne |
| 9 | C9H20 _ | Nonane | C9H16 _ | Žádné |
| 10 | C10H22 _ | Dekane | C10H18 _ | Decyne |
Získávání alkynů, jak je vidět u ethynu
- Reakce karbidu s vodou:
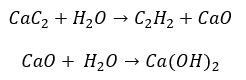
- Pyrolýza:
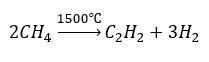
- Vysokoteplotní syntéza:
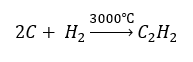
- Částečná oxidace zemního plynu:
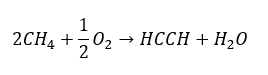
Vyšší alkyny se získávají v průmyslovém měřítku použitím ethynu a například formaldehydu jako reakčních činidel při kondenzační reakci. Další metodou je dvojnásobná eliminace halogenovodíku z příslušných alkylhalogenidů, které obsahují dva atomy halogenu a jsou připojeny k jednomu atomu uhlíku nebo k sousedním atomům uhlíku. V druhém případě existují dva možné produkty: alkyn a dien. Níže je uveden příklad reakce tvorby propinu: 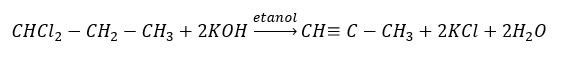
Reakce charakteristické pro alkyny:
- Celkové spalování s tvorbou obsahu:
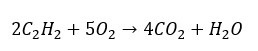
- Částečné spalování s tvorbou oxidu uhelnatého nebo sazí:
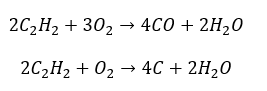
- Hydrogenační reakce v přítomnosti kovových katalyzátorů (Pd, Pt, Fe, Ni), vedoucí ke vzniku alkenů. Může se vyskytovat ve fázích, kdy se postupně přidávají jednotlivé molekuly vodíku, nebo všechny najednou, s tvorbou alkanu:
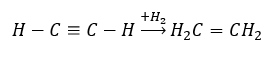
- Kucherovova reakce, typická pro alkyny, zahrnuje přidání částice vody v oblasti trojných vazeb, které probíhají ve dvou stupních. Zpočátku se tvoří nestabilní enol, což je kombinace alkenu a alkoholu. Poté podléhá keto-enolové tautomerii, tj. přeskupení s tvorbou aldehydů nebo ketonů. Konverze se provádí pomocí elektrofilního mechanismu:
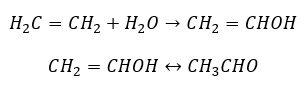
- Elektrofilní adiční reakce s HC1 nebo HBr, probíhající v souladu s Markovnikovovým pravidlem. Může se vyskytovat v celku nebo ve více fázích.
- Elektrofilní adice bromu s produkcí di- nebo tetra-bromderivátů. Kvůli reakcím s bromem alkyny odbarvují bromovou vodu. Reagují také s částicemi chlóru .
- Reakce adiční reakce s volnými radikály fluoridu, která se provádí pod vlivem světelné energie.
- Substituční reakce, kdy je atom vodíku na atomu uhlíku s trojnou vazbou vytěsněn atomem kovu.
- Trimerizace, tj. polymerace se třemi molekulami, pomocí acetylenu, který umožňuje benzen.

