Antara sebatian kimia organik yang dikelaskan sebagai hidrokarbon tak tepu, kita boleh membezakan kumpulan yang dipanggil alkuna. Mereka tergolong dalam kumpulan sebatian ini kerana strukturnya - molekul mengandungi hanya atom karbon dan hidrogen, dan salah satu ikatan antara atom karbon adalah tak tepu. Untuk alkuna, ini ialah ikatan rangkap tiga C≡C. Banyak wakil kumpulan boleh didapati dalam produk harian seperti petrol, dakwat, dan racun perosak, tetapi juga dalam kosmetik, di mana mereka mempunyai peranan antioksidan.

Struktur alkuna
Formula umum untuk alkuna ialah C n H 2n-2 , dan setiap satu mengandungi sekurang-kurangnya satu ikatan rangkap tiga. Secara struktur, ia adalah isomer bagi diena, sikloalkena dan sikloalkena dua cincin. Alkuna, seperti alkana atau alkena, mempunyai struktur rantai yang sama ada lurus atau bercabang. Selain daripada ikatan rangkap tiga, iaitu ikatan kovalen, terdapat hanya ikatan CC tunggal tetapi juga kovalen lain antara atom karbon dan ikatan CH antara atom karbon dan hidrogen. Ikatan rangkap tiga hanya akan berlaku jika dua atom karbon berturut-turut terletak secara spatial dalam hibridisasi sp linear. Panjang ikatan ini adalah lebih kurang 0.120 nm. Contohnya, dalam etena, satu hibrid karbon bergabung dengan orbital atom hidrogen untuk menghasilkan ikatan sigma kovalen sp-s (δ sp-s ). Yang kedua, sebaliknya, mengikat dengan ikatan sigma sp-sp (δ sp-sp ) analog yang menyebabkan hibrid lain bergabung dengan atom hidrogen. Perubahan sedemikian mewujudkan kerangka molekul linear. Disebabkan penghibridan sp yang terhasil, dua orbital p berserenjang dengan paksi ikatan juga terdapat, yang mana dua ikatan π antara atom karbon akhirnya dihasilkan. Tiada putaran di sekeliling ikatan rangkap tiga.
Alkuna – tatanama
Terdapat beberapa prinsip asas yang perlu diikuti apabila menamakan sebatian kimia ini:
- Kehadiran ikatan rangkap tiga tak tepu dalam struktur yang ditunjukkan oleh akhiran ‘-yne’ menggantikan akhiran ‘-ane’ dalam nama homolog alkana yang berkaitan. Dalam kes di mana beberapa lokasi ikatan sedemikian mungkin, akhiran ‘-yne’ sentiasa mendahului nombor yang berkaitan, menunjukkan pencari bon, seperti hept-2-yne atau hept-1-yne. Locant juga boleh diletakkan di awal nama, contohnya 1-butyne.
- Untuk struktur yang mengandungi lebih daripada satu ikatan rangkap tiga, awalan ditambah pada akhir untuk menunjukkan nombor. Ini akan menjadi -di, -tri, dsb., masing-masing.
- Penomboran atom karbon mesti mengikut arah mana rantai utama mengandungi sebanyak mungkin atom karbon serta ikatan rangkap tiga.
- Dalam kes di mana satu-satunya ikatan tak tepu ialah ikatan rangkap tiga, atom karbon hendaklah dinomborkan supaya ia mempunyai nombor yang paling rendah. Peraturan ini tidak terpakai jika terdapat ikatan tak tepu lain (berganda), dalam hal ini, locantnya mestilah serendah mungkin.
- Atas nama sebatian dengan satu ikatan rangkap tiga di sebelah lokan pertama, nombor itu boleh ditinggalkan, dengan kata lain, nama prop-1-yne boleh digunakan serta nama propyne
Sifat fiziko-kimia alkuna
Sifat alkuna adalah non-polar, ia adalah hidrofobik, dan ia bertindak balas dengan udara. Sebaiknya, ia larut dalam pelarut bukan kutub yang serupa seperti alkana. Apabila rantai karbon memanjang, takat lebur, takat didih dan ketumpatannya meningkat. Walau bagaimanapun, aktiviti mereka berkurangan pada masa yang sama. Yang paling reaktif ialah yang mempunyai atom karbon paling sedikit dalam rantai. Berbanding dengan alkana dan alkena, ia lebih reaktif sedikit kerana ikatan rangkap tiga kurang daripada ikatan tunggal atau berganda. Struktur molekul mereka juga menyebabkan kemudahbakaran tinggi sebatian ini. Salah satu tindak balas balas ciri alkuna ialah tindak balas pembakaran. Mereka mampu menambah reagen elektrofilik di tempat ikatan tak tepu. Mereka menjalani tindak balas pempolimeran.
Siri homolog alkuna
Seperti alkana dan alkena, alkuna juga mempunyai siri homolognya sendiri, iaitu, hierarki sebatian asasnya, yang mengandungi tepat satu ikatan rangkap tiga yang dikelaskan mengikut peningkatan bilangan atom karbon dalam struktur. Sebatian yang memulakan siri homolog alkuna ialah etana, juga dipanggil asetilena, yang mempunyai dua atom karbon dan dua atom hidrogen dalam strukturnya
| Bilangan atom karbon dalam rantai | Formula alkana | nama alkana | Formula alkuna | nama alkuna |
| 2 | C 2 H 6 | Ethane | C 2 H 2 | Ethyne |
| 3 | C 3 H 8 | propana | C 3 H 4 | Propyne |
| 4 | C 4 H 10 | Butana | C 4 H 6 | Butyne |
| 5 | C 5 H 12 | Pentane | C 5 H 8 | Pentyne |
| 6 | C 6 H 14 | Heksana | C 6 H 10 | Hexyne |
| 7 | C 7 H 16 | Heptana | C 7 H 12 | Heptyne |
| 8 | C 8 H 18 | oktana | C 8 H 14 | Octyne |
| 9 | C 9 H 20 | Nonane | C 9 H 16 | Tiada siapa |
| 10 | C 10 H 22 | Decane | C 10 H 18 | Decyne |
Mendapatkan alkuna seperti yang dilihat dengan ethyne
- Tindak balas karbida dengan air:
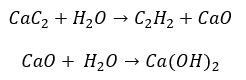
- Pirolisis:
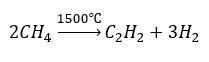
- Sintesis suhu tinggi:
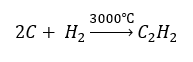
- Pengoksidaan separa gas asli:
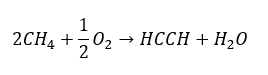
Alkuna yang lebih tinggi diperoleh pada skala industri dengan menggunakan sebagai reagen etina dan, sebagai contoh, formaldehid dalam tindak balas pemeluwapan. Kaedah lain ialah penyingkiran dua kali ganda hidrogen halida daripada alkil halida yang berkaitan yang mengandungi dua atom halogen dan dilekatkan pada satu atom karbon atau pada atom karbon bersebelahan. Dalam kes kedua, terdapat dua produk yang mungkin: alkuna dan diena. Di bawah ialah contoh tindak balas pembentukan propina: 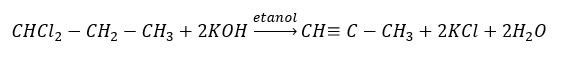
Ciri-ciri tindak balas untuk alkuna:
- Jumlah pembakaran dengan penjanaan karbon dioksida:
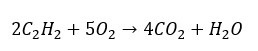
- Pembakaran separa dengan penjanaan karbon monoksida atau jelaga:
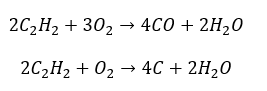
- Tindak balas penghidrogenan dengan kehadiran pemangkin logam (Pd, Pt, Fe, Ni), menghasilkan pembentukan alkena. Ia mungkin berlaku secara berperingkat, dengan molekul hidrogen individu berturut-turut ditambah, atau sekaligus, dengan pembentukan alkana:
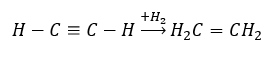
- Tindak balas Kucherov, tipikal untuk alkuna, melibatkan penambahan zarah air di kawasan ikatan rangkap tiga, yang berlaku dalam dua peringkat. Pada mulanya, enol yang tidak stabil terbentuk, yang merupakan gabungan alkena dan alkohol. Ia kemudiannya mengalami tautomerisme keto-enol, iaitu pengumpulan semula dengan pembentukan aldehid atau keton. Penukaran dilakukan dengan cara mekanisme elektrofilik:
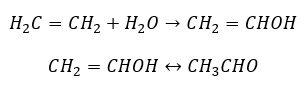
- Tindak balas penambahan elektrofilik dengan HCl atau HBr, mengikut peraturan Markovnikov. Ia mungkin berlaku secara keseluruhan atau dalam beberapa peringkat.
- Penambahan elektrofilik bromin, dengan penghasilan derivatif di- atau tetra-bromo. Kerana tindak balas dengan bromin, alkuna mengubah warna air bromin. Mereka juga bertindak balas dengan zarah klorin .
- Tindak balas penambahan fluorida radikal bebas, yang dijalankan di bawah pengaruh tenaga cahaya.
- Tindak balas penggantian, di mana atom hidrogen pada atom karbon ikatan rangkap tiga disesarkan oleh atom logam.
- Trimerisasi, iaitu, pempolimeran dengan tiga molekul, menggunakan asetilena, yang membolehkan sintesis benzena.

