Parmi les composés chimiques organiques classés comme hydrocarbures insaturés, on peut distinguer le groupe appelé alcynes. Ils appartiennent à ce groupe de composés en raison de leur structure - la molécule ne contient que des atomes de carbone et d'hydrogène, et l'une des liaisons entre les atomes de carbone est insaturée. Pour les alcynes, il s'agit d'une triple liaison C≡C. De nombreux produits du groupe se retrouvent dans les produits du quotidien tels que l'essence, l'encre, les pesticides, mais aussi dans les cosmétiques, où ils ont le rôle d'antioxydants.

La structure des alcynes
La formule générale des alcynes est C n H 2n-2 , et chacun contient au moins une triple liaison. Structurellement, ce sont des isomères de diènes, de cycloalcènes et de cycloalcènes à deux cycles. Les alcynes, comme les alcanes ou les alcènes, ont une structure de chaîne droite ou ramifiée. Outre la triple liaison, qui est une liaison covalente, il n’existe que d’autres liaisons CC simples mais également covalentes entre les atomes de carbone et des liaisons CH entre les atomes de carbone et d’hydrogène. La triple liaison ne se justifie que si deux atomes de carbone consécutifs sont situés dans l’espace dans une hybridation sp linéaire. La longueur de cette liaison est d’environ 0,120 nm. Par exemple, dans l’éthyne, un hybride de carbone se joint à l’orbitale d’un atome d’hydrogène pour produire une liaison sigma covalente sp-s (δ sp-s ). La seconde, d’autre part, se lie avec une liaison sigma analogue sp-sp (δ sp-sp ) résultant en un autre hybride joignant un atome d’hydrogène. De tels changements entraînent la formation de la charpente linéaire de la molécule. En raison de l’hybridation sp résultée, deux orbitales p perpendiculaires à l’axe de liaison sont également présentes, à partir desquelles deux liaisons π entre les atomes de carbone sont finalement produites. Il n’y a pas de rotation autour de la triple liaison.
Alcynes – nomenclature
Il y a plusieurs principes de base à suivre pour nommer ces composés chimiques :
- La présence d’une triple liaison insaturée dans la structure est indiquée par le suffixe « -yne » remplaçant le suffixe « -ane » dans le nom de l’homologue d’alcane concerné. Dans le cas où plusieurs emplacements d’une telle liaison sont possibles, le suffixe ‘-yne’ précède toujours le nombre pertinent, indiquant le locant de la liaison, tel que hept-2-yne ou hept-1-yne. Le locant peut également être placé au début du nom, par exemple 1-butyne.
- Pour les structures qui contiennent plus d’une triple liaison, un préfixe est ajouté au suffixe pour indiquer le nombre. Ce seront -di, -tri, etc., respectivement.
- La numérotation des atomes de carbone doit prendre une direction dans laquelle la chaîne principale contient autant d’atomes de carbone que possible ainsi que la triple liaison.
- Dans le cas où la seule liaison insaturée est la triple liaison, les atomes de carbone doivent être numérotés de manière à avoir le plus petit nombre possible. Cette règle ne s’applique pas s’il existe d’autres liaisons insaturées (doubles), auquel cas leurs locants doivent être les plus bas possibles.
- Dans le nom d’un composé avec une triple liaison à côté du premier locant, le nombre peut être omis, en d’autres termes, le nom prop-1-yne peut être utilisé ainsi que le nom propyne
Les propriétés physico-chimiques des alcynes
La nature des alcynes est non polaire, ils sont hydrophobes et ils réagissent avec l’eau. De préférence, ils se dissolvent dans des solvants non polaires similaires tels que des alcanes. Au fur et à mesure que la chaîne carbonée s’allonge, leur point de fusion, leur point d’ébullition et leur densité augmentent. Cependant, leur activité diminue en même temps. Les plus réactifs sont ceux qui ont le moins d’atomes de carbone dans la chaîne. Comparés aux alcanes et aux alcènes, ils sont légèrement plus réactifs car la triple liaison est inférieure à une liaison simple ou double. Leur structure moléculaire se traduit également par la grande inflammabilité de ces composés. L’une des réactions caractéristiques des alcynes est la réaction de combustion. Ils sont capables d’ajouter un réactif électrophile à la place de la liaison insaturée. Ils subissent des réactions de propagation.
Série homologue Alcyne
Comme les alcanes et les alcènes, les alcynes ont aussi leur propre série d’homologues, c’est-à-dire leur hiérarchie de composés basiques, qui contient exactement une triple liaison classée selon le nombre croissant d’atomes de carbone dans la structure . Le composé qui commence la série homologue des alcynes est l’éthyne, également appelé acétylène, qui a deux atomes de carbone et deux atomes d’hydrogène dans sa structure.
| Nombre d’atomes de carbone dans la chaîne | Formule alcane | Nom de l’alcane | Formule alcyne | Nom alcyne |
| 2 | C 2 H 6 | Éthane | C2H2 _ | Éthyne |
| 3 | C 3 H 8 | Propane | C 3 H 4 | Propyne |
| 4 | C 4 H 10 | Butane | C 4 H 6 | butyne |
| 5 | C 5 H 12 | Pentane | C 5 H 8 | Pentyne |
| 6 | C 6 H 14 | Hexane | C 6 H 10 | Hexyne |
| septembre | C 7 H 16 | Heptane | C 7 H 12 | Heptyne |
| 8 | C 8 H 18 | Octane | C 8 H 14 | Octyne |
| 9 | C 9 H 20 | Nonane | C 9 H 16 | Nonyne |
| dix | C 10 H 22 | Décane | C 10 H 18 | Décyne |
Obtention d’alcynes comme on le voit avec l’éthyne
- La réaction du carburateur avec l’eau :
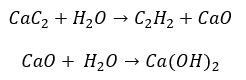
- Pyrolyse :
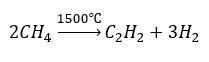
- Synthèse à haute température :
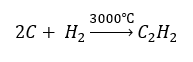
- Oxydation partielle du gaz naturel :
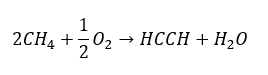
Les alcynes supérieurs sont obtenus à l’échelle industrielle en utilisant comme réactifs l’éthyne et, par exemple, le formaldéhyde dans la réaction de condensation. Une autre méthode est la double élimination de l’halogénure d’hydrogène des halogénures d’alkyle pertinentes qui contiennent deux atomes d’halogène et sont attachées à un atome de carbone ou à des atomes de carbone adjacents. Dans ce dernier cas, il y a deux produits possibles : un alcyne et un diène. Ci-dessous un exemple de réaction de formation de propyne : 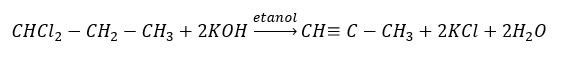
Réactions caractéristiques des alcynes :
- Combustion totale avec génération de dioxyde de carbone :
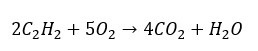
- Combustion partielle avec génération de monoxyde de carbone ou de suie :
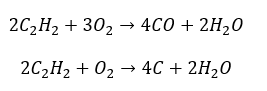
- Réaction d’hydrogénation en présence de catalyseurs métalliques (Pd, Pt, Fe, Ni), entraînant la formation d’alcènes. Il peut se produire par étapes, avec des molécules d’hydrogène individuelles successives ajoutées, ou toutes à la fois, avec formation d’alcane :
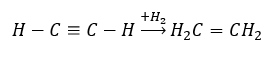
- La réaction de Kucherov, typique des alcynes, implique l’ajout d’une particule d’eau dans la zone de la triple liaison, qui se déroule en deux étapes. Initialement, un énol instable est formé, qui est une combinaison d’un alcène et d’un alcool. Il subit alors la tautomérie céto-énolique, c’est-à-dire un regroupement avec formation d’aldéhydes ou de cétones. La conversion s’effectue par l’intermédiaire d’un mécanisme électrophile :
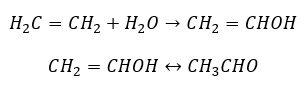
- La réaction d’addition électrophile avec HCl ou HBr, se produit conformément à la règle de Markovnikov. Elle peut se produire en tout ou en plusieurs étapes.
- L’addition électrophile du brome, avec production de dérivés di- ou tétra-bromo. En raison des réactions avec le brome, les alcynes décolorent l’eau bromée. Ils réagissent également avec les particules de chlore .
- Réaction d’addition radicalaire de fluorure, qui s’effectue sous l’influence de l’énergie lumineuse.
- Réactions de substitution, où l’atome d’hydrogène au niveau de l’atome de carbone à triple liaison est déplacé par un atome de métal.
- La trimérisation, c’est-à-dire la polymérisation à trois molécules, à l’aide d’acétylène, qui permet la synthèse du benzène.

