Серед органічних хімічних сполук, які відносять до ненасичених вуглеводнів, можна виділити групу алкінів. Вони належать до цієї групи сполук завдяки своїй будові – молекула містить лише атоми вуглецю та водню, а один із зв’язків між атомами вуглецю є ненасиченим. Для алкінів це потрійний зв’язок C≡C. Багато представників цієї групи можна знайти в повсякденних продуктах, таких як бензин, чорнило та пестициди, а також у косметиці, де вони виконують роль антиоксидантів.

Будова алкінів
Загальна формула алкінів C n H 2n-2 , і кожен містить мінімум один потрійний зв’язок. За будовою вони є ізомерами дієнів, циклоалкенів і двокільцевих циклоалкенів. Алкіни, як і алкани або алкени , мають пряму або розгалужену структуру ланцюга. Окрім потрійного зв’язку, який є ковалентним зв’язком, існують лише інші одинарні, але також ковалентні зв’язки CC між атомами вуглецю та зв’язки CH між атомами вуглецю та водню. Потрійний зв’язок виникне, лише якщо два послідовні атоми вуглецю просторово розташовані в лінійній sp-гібридизації. Довжина цього зв’язку становить приблизно 0,120 нм. Наприклад, в етині один гібрид вуглецю з’єднується з орбіталлю атома водню, утворюючи sp-s (δ sp-s ) ковалентний сигма-зв’язок. Другий, з іншого боку, зв’язується аналогічним sp-sp (δ sp-sp ) сигма-зв’язком, у результаті чого інший гібрид приєднується до атома водню. Такі зміни призводять до формування лінійного каркаса молекули. Через результуючу sp-гібридизацію також присутні дві p-орбіталі, перпендикулярні до осі зв’язку, з яких зрештою утворюються два π-зв’язки між атомами вуглецю. Немає обертання навколо потрійного зв’язку.
Алкіни – номенклатура
Є кілька основних принципів, яких слід дотримуватися, називаючи ці хімічні сполуки:
- На наявність ненасиченого потрійного зв’язку в структурі вказує суфікс «-yne», який замінює суфікс «-ane» у назві відповідного гомолога алкану. У випадку, коли можливі декілька місць такого зв’язку, суфікс «-yne» завжди стоїть перед відповідним числом, що вказує на локант зв’язку, наприклад гепт-2-ін або гепт-1-ін. Локант також може стояти на початку назви, наприклад, 1-butyne.
- Для структур, які містять більше одного потрійного зв’язку, до суфікса додається префікс, щоб вказати кількість. Це відповідно будуть -ди, -три тощо.
- Нумерація атомів вуглецю повинна мати такий напрямок, щоб головний ланцюг містив якомога більше атомів вуглецю, а також потрійний зв’язок.
- У випадку, коли єдиним ненасиченим зв’язком є потрійний зв’язок, атоми вуглецю мають бути пронумеровані так, щоб вони мали найменший можливий номер. Це правило не застосовується, якщо є інші ненасичені зв’язки (подвійні), у цьому випадку їхні локанти мають бути якомога нижчими.
- У назві сполуки з одним потрійним зв’язком поряд з першим локантом число можна опустити, іншими словами, можна використовувати назву проп-1-ін, а також назву пропін
Фізико-хімічні властивості алкінів
Природа алкінів неполярна, вони гідрофобні, реагують з водою. Переважно, вони розчиняються в аналогічних неполярних розчинниках, таких як алкани. У міру подовження вуглецевого ланцюга їх температура плавлення, температура кипіння та щільність зростають. Однак при цьому їх активність знижується. Найбільш реакційноздатними є ті, у ланцюзі яких найменше атомів вуглецю. Порівняно з алканами та алкенами вони дещо більш реакційноздатні через те, що потрійний зв’язок менший, ніж одинарний або подвійний. Їх молекулярна структура також призводить до високої займистості цих сполук. Однією з характерних реакцій алкінів є реакція горіння. Вони здатні додавати електрофільний реагент на місці ненасиченого зв’язку. Вони вступають в реакції полімеризації.
Гомологічний ряд алкінів
Подібно до алканів і алкенів, алкіни також мають свій власний гомологічний ряд, тобто свою ієрархію основних сполук, які містять точно один потрійний зв’язок, класифікований відповідно до збільшення кількості атомів вуглецю в структурі. Сполукою, яка починає гомологічний ряд алкінів, є етин, також званий ацетиленом, у структурі якого є два атоми вуглецю та два атоми водню.
| Кількість атомів Карбону в ланцюгу | Формула алкану | Назва алкану | Алкінова формула | Алкінна назва |
| 2 | C 2 H 6 | Етан | C 2 H 2 | Етін |
| 3 | C 3 H 8 | пропан | C 3 H 4 | Пропін |
| 4 | C 4 H 10 | Бутан | C 4 H 6 | Бутине |
| 5 | C 5 H 12 | Пентан | C 5 H 8 | Пентин |
| 6 | C 6 H 14 | Гексан | C 6 H 10 | Гексин |
| 7 | C 7 H 16 | Гептан | C 7 H 12 | Гептин |
| 8 | C 8 H 18 | Октан | C 8 H 14 | Октин |
| 9 | C 9 H 20 | Nonane | C 9 H 16 | Жодного |
| 10 | C 10 H 22 | Декан | C 10 H 18 | Decyne |
Отримання алкінів за етином
- Реакція карбіду з водою:
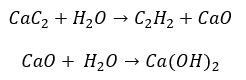
- Піроліз:
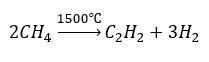
- Високотемпературний синтез:
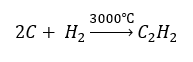
- Часткове окислення природного газу:
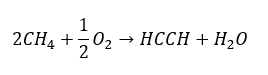
Вищі алкіни одержують у промисловому масштабі, використовуючи в якості реагентів етин і, наприклад, формальдегід в реакції конденсації. Іншим методом є подвійне видалення галогеніду водню з відповідних алкілгалогенідів, які містять два атоми галогену та приєднані до одного атома вуглецю або до сусідніх атомів вуглецю. В останньому випадку можливі два продукти: алкін і дієн. Нижче наведено приклад реакції утворення пропіну: 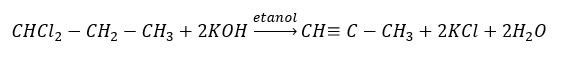
Реакції, характерні для алкінів:
- Повне згоряння з утворенням вуглекислого газу:
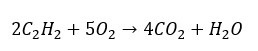
- Часткове згоряння з утворенням чадного газу або сажі:
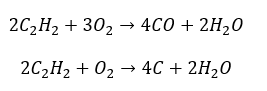
- Реакція гідрування в присутності металевих каталізаторів (Pd, Pt, Fe, Ni), в результаті якої утворюються алкени. Це може відбуватися поетапно, з послідовним додаванням окремих молекул водню, або всі відразу, з утворенням алкану:
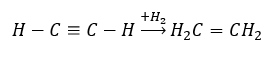
- Типова для алкінів реакція Кучерова полягає в приєднанні частинки води в області потрійного зв’язку, що відбувається в два етапи. Спочатку утворюється нестабільний енол, який є з’єднанням алкена і спирту. Потім він зазнає кето-енольної таутомерії, тобто перегрупування з утворенням альдегідів або кетонів. Перетворення здійснюється за допомогою електрофільного механізму:
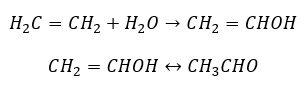
- Реакція електрофільного приєднання з HCl або HBr, що відбувається за правилом Марковникова. Він може відбуватися повністю або в кілька етапів.
- Електрофільне приєднання брому з утворенням ди- або тетрабромпохідних. Через реакції з бромом алкіни змінюють колір бромної води. Вони також реагують з частинками хлору .
- Реакція вільнорадикального приєднання фтору, яка здійснюється під впливом енергії світла.
- Реакції заміщення, коли атом водню в атомі вуглецю з потрійним зв’язком заміщується атомом металу.
- Тримеризація, тобто полімеризація з трьома молекулами за допомогою ацетилену, що дозволяє синтезувати бензол.

