Medzi organické chemické zlúčeniny, ktoré sú klasifikované ako nenasýtené uhľovodíky, môžeme rozlíšiť skupinu nazývanú alkíny. Do tejto skupiny patrí väzba so svojou štruktúrou – molekula obsahuje iba atómy uhlíka a vodíka a jednu z atómov medzi atómami uhlíka je nenasýtená. Pre alkíny je to trojitá väzba C≡C. Mnoho zástupcov skupiny nájdeme v produktoch každodennej potreby ako benzín, atrament, pesticídy, ale aj v kozmetike, kde majú úlohu antioxidantov.

Štruktúra alkinov
Všeobecný vzorec pre alkíny je CnH2n -2 a každý obsahuje minimálne jednu trojitú súvislosť. Štruktúrne ide o izoméry diénov, cykloalkénov a dvojkruhových cykloalkénov. Alkiny, podobne ako alkány alebo alkény, majú štruktúru reťazca, ktorá je buď priama alebo rozvetvená. Okrem trojitej väzby, ktorá je kovalentnou väzbou, existujú len ďalšie jednoduché, ale aj kovalentné väzby CC medzi atómami uhlíka a väzby CH medzi atómami uhlíka a vodíka. K trojitej väzbe dôjde iba vtedy, ak sú dva po sebe idúce atómy a priestory umiestnené v lineárnej sp hybridizácii. Dĺžka tejto väzby je približne 0,120 nm. Napríklad v etíne sa jeden uhlíkový hybrid spája s orbitálnym atómom vodíka za vzniku sp-s (δ sp-s ) kovalentnej sigma väzby. Druhá sa na druhej strane viaže s analogickou sp-sp (δ sp-sp ) sigma väzbou, čo vedie k ďalšiemu hybridu spájajúcemu atóm vodíka. zmeny vedú k tvorbe lineárneho rámca molekúl. V dôsledku výslednej sp hybridizácie sú tiež prítomné dve orbitály na os väzby, z ktorých nakoniec vytvoria dve väzby π medzi atómami uhlíka. Okolo trojitej väzby nedochádza k rotácii.
Alkiny – nomenklatúra
Pri pomenovaní týchto chemických zlúčenín je potrebné dodržiavať niekoľko základných zásad:
- Prítomnosť nenasýtenej trojitej väzby v štruktúre je indikovaná príponou „-yne“, ktorá nahrádza príponu „-ane“ v názve príslušného homológa alkánu. V prípade, že je možné niekoľko umiestnení takejto väzby, prípona „-yne“ vždy predchádza príslušnému číslu, čo označuje lokantnú väzbu, ako napríklad hept-2-yne alebo hept-1-yne. Lokant môže byť umiestnený aj na začiatku názvu, napríklad 1-butín.
- Pre štruktúru, ktoré obsahujú viac ako jednu trojitú súvislosť, sa k tomu pridá predpona, ktorá označuje číslo. Bude to -di, -tri atď.
- Číslovanie atómov uhlíka musí mať smer, v ktorom hlavný reťazec obsahuje čo najviac atómov uhlíka, ako aj trojitú súvislosť.
- V prípade, že jedinou väzbou je trojitá väzba, atómy uhlíka sa očíslujú tak, aby ich počet bol čo najnižší. Toto pravidlo neplatí, ak existujú iné nenasýtené dlhopisy (dvojité), v takom prípade musia byť ich lokanty čo najnižšie.
- V názve zlúčeniny prvého s jednou trojitou väzbou vedľa lokantu možno číslo zadať inými slovami, názov prop-1-yne možno použiť aj názov propín
Fyzikálno-chemické vlastnosti alkinov
Povaha alkinov je nepolárna, sú hydrofóbne a reagujú s vodou. Výhodne sa rozpúšťajú v podobných nepolárnych rozpúšťadlách, ako sú alkány. S predlžovaním uhlíkového reťazca sa zvyšuje ich teplota topenia, teplota varu a hustota. Ich aktivita však zároveň klesá. Najaktívnejšie sú tie s najmenším počtom atómov uhlíka v reťazci. V porovnaní s alkánmi a alkénmi sú o niečo reaktívnejšie, pretože trojitá väzba je menšia ako jednoduchá alebo dvojitá väzba. Ich molekulárna štruktúra má za následok aj vysokú horľavosť týchto zlúčenín. Jednou z charakteristických reakcií alkinov je reakcia horenia. Sú schopné pridať elektrofilné činidlo na miesto nenasýtenej väzby. Prechádzajú polymerizačnými reakciami.
Alkynová homologická séria
Rovnako ako alkány a alkény, aj alkíny majú svoj vlastný homológny rad, tj hierarchiu základných zlúčenín, ktoré obsahujú práve jednu trojitú súvislosť, ktorá je klasifikovaná podľa zvyšujúceho sa počtu atómov uhlíka v štruktúre. okolo, ktorá začína alkínovú homologickú sériu, je etín, tiež nazývaný acetylén, ktorý má vo svojej štruktúre dva atómy uhlíka a dva atómy vodíka.
| Počet atómov uhlíka v reťazci | Alkánový vzorec | Alkánový názov | Alkinový vzorec | Meno Alkyne |
| 2 | C2H6 _ | Etan | C2H2 _ | Ethyne |
| 3 | C3H8 _ | Propán | C3H4 _ | Propyne |
| 4 | C4H10 _ | bután | C4H6 _ | Butyne |
| 5 | C5H12 _ | pentán | C5H8 _ | Pentyne |
| 6 | C6H14 _ | Hexán | C6H10 _ | Hexyne |
| 7 | C7H16 _ | heptán | C7H12 _ | Heptyne |
| 8 | C8H18 _ | Oktánový | C8H14 _ | Octyne |
| 9 | C9H20 _ | Nonane | C9H16 _ | Žiadna |
| 10 | C10H22 _ | Decane | C10H18 _ | Decyne |
Získavanie alkinov, ako je vidieť pri etíne
- Reakcia karbidu s vodou:
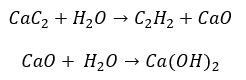
- Pyrolýza:
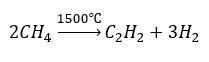
- Vysokoteplotná syntéza:
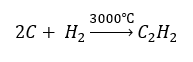
- Čiastočná oxidácia zemného plynu:
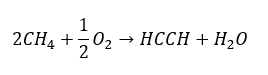
Vyššie alkíny sa získavajú v priemyselnom meradle použitím etína a napríklad formaldehydu ako reakčných činidiel pri kondenzačnej reakcii. Metóda je dvojnásobná eliminácia halogénovodíka z príslušných alkylhalogenidov, ktoré obsahujú dva atómy halogénu a sú pripojené k jednému atómu uhlíka alebo k susednému atómu uhlíka. V druhom prípade existujú dva možné produkty: alkín a dién. Nižšie je uvedený príklad reakcie tvorby prepína: 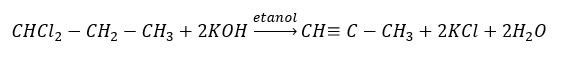
Charakteristické reakcie pre alkíny:
- Celkové spaľovanie s tvorbou obsahu:
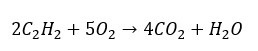
- Čiastočné spaľovanie s tvorbou oxidu uhoľnatého alebo sadzí:
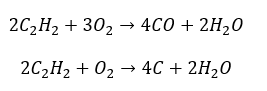
- Hydrogenačná reakcia v prítomnosti kovových katalyzátorov (Pd, Pt, Fe, Ni), ktorá vedie k tvorbe alkénov. Môže sa vyskytovať v etapách, s postupným pridávaním jednotlivých molekúl vodíka alebo naraz, s tvorbou alkánov:
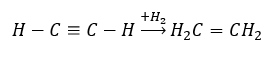
- Kucherovova reakcia, typická pre alkíny, zahŕňa pridanie časti vody v oblasti trojitej väzby, ktorá prebieha v dvoch stupňoch. Spočiatku vzniká nestabilný enol, ktorý je kombináciou alkénu a alkoholu. Potom podlieha keto-enolovej tautomérii, tj preskupeniu s tvorbou aldehydov alebo ketónov. Konverzia zabezpečuje prostredníctvom elektrofilného mechanizmu:
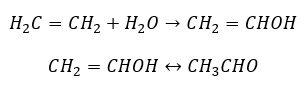
- Elektrofilná adičná reakcia s HCl alebo HBr, prebiehajúca v súlade s Markovnikovovým pravidlom. Môže sa vyskytnúť ako celok alebo vo viacerých fázach.
- Elektrofilná adícia brómu s produkciou di- alebo tetrabrómderivátov. V dôsledku reakcie s brómom alkíny odfarbujú brómovú vodu. Reagujú aj s časťami chlóru .
- Adičná reakcia s voľnými radikálmi fluoridu, ktorá pôsobí pod vplyvom svetelnej energie.
- Substitučné reakcie, pri ktorých je atóm vodíka na atóm uhlíka s trojitou väzbou nahradený atómom kovu.
- Trimerizácia, tj polymerizácia s tromi molekulami s použitím cetylénu, ktorý umožňuje syntézu a benzénu.

