Alkany należą pod względem struktury chemicznej do grupy węglowodorów. Są to związki, zawierające jedynie dwa typy atomów – węgla oraz wodoru. Składają się z podstawowego szkieletu węglowego oraz przyłączonych do nich atomów wodoru. W przypadku alkanów, wszystkie wiązania są pojedyncze, dlatego nazywa się je węglowodorami nasyconymi.

Szereg homologiczny
Przedstawiciele alkanów, uszeregowani względem wzrostowej ilości atomów wodoru w strukturze, tworzą szereg homologiczny. Rozpoczyna się on od metanu zawierającego jeden atom węgla, a kończący na dziesięciowęglowym dekanie. Nazewnictwo alkanów pochodzi od ilości atomów węgla, opisanych liczebnikami greckimi lub łacińskimi, obecnych w strukturze oraz charakterystycznej końcówki –an, na przykład heptan, nonan itp..
Ogólny wzór alkanów to: , gdzie „n” oznacza liczbę atomów węgla (C) obecnych w łańcuchu, natomiast „H” oznacza atomy wodoru.
| Liczba atomów węgla, obecna w łańcuchu | Wzór alkanu | Nazwa alkanu |
| 1 | CH4 | Metan |
| 2 | C2H6 | Etan |
| 3 | C3H8 | Propan |
| 4 | C4H10 | Butan |
| 5 | C5H12 | Pentan |
| 6 | C6H14 | Heksan |
| 7 | C7H16 | Heptan |
| 8 | C8H18 | Oktan |
| 9 | C9H20 | Nonan |
| 10 | C10H22 | Dekan |
Rodzaje węglowodorów nasyconych
Ze względu na budowę łańcucha, alkany dzielimy na:
-
Prostołańcuchowe (parafinowe)
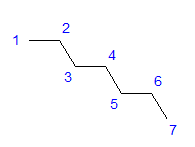
Rys. 1 Wzór strukturalny heptanu
Wszystkie atomy węgla posiadają hybrydyzację sp3. Ze względu na tetragonalny kąt pomiędzy wiązaniami, konieczny jest układ atomów węgla o zygzakowatym kształcie. Cząsteczki mogą przyjmować różne układy, ponieważ możliwa jest swobodna rotacja wokół pojedynczego wiązania pomiędzy atomami węgla. Im wyższa liczba węgli w danej strukturze, tym większe możliwości różnorodności kształtów łańcuchów.
-
Izoalkany, czyli rozgałęzione węglowodory nasycone
Powstawanie węglowodorów rozgałęzionych jest skutkiem łączenia się atomu węgla z więcej niż dwoma innymi atomami węgla. W miejscu takiego połączenia tworzy się rozgałęzienie. Węglowodory rozgałęzione stanowią izomery węglowodorów prostołańcuchowych.
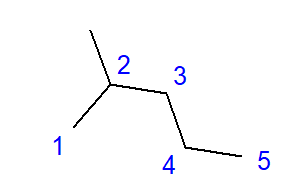
Rys. 2 Wzór strukturalny 2-metylopenatnu
Pokazany na rys. 2 wzór 2-metylopentanu posiada sumarycznie sześć atomów węgla i jest izomerem heksanu. Nazwa 2-metylopentan oznacza, że łańcuch pentanu posiada w pozycji drugiego węgla, przyłączoną grupę metylową. Wraz we wzrostem liczby atomów węgla w cząsteczce, wzrasta liczba możliwych izomerów konstytucyjnych. Dla przykładu, heksan może posiadać budowę 5 różnych izomerów, oktan ma takich możliwości 18, a dekan aż 75.
-
Węglowodory pierścieniowe – cykloalkany, węglowodory alicykliczne
Możliwe jest zamknięcie się struktury łańcucha, z wytworzeniem pierścieni złożonych z powtarzających się elementów –CH2-. Nazwy tworzy się na podstawie nazwy alkanu, z przedrostkiem cyklo-, na przykład cyklobutan, cykloheptan. Pomocniczo, przedstawia się je w postaci wieloboków foremnych.
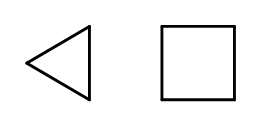
Rys. 3 Od lewej: cyklopropan, cyklobutan
Istnieją również pierścienie podstawione, w których nazwie wymienia się podstawniki. W takim wypadku, numeracja atomów węgla oznaczana jest tak, aby podstawniki miały możliwie najniższą lokację.
Czołowi przedstawiciele grupy
Metan to związek o wzorze sumarycznym CH4, rozpoczynający szereg homologiczny alkanów. Węgiel jest czterowartościowy, a więc posiada cztery wiązania C-H. W temperaturze pokojowej jest gazem, bezwonnym i bezbarwnym. Ponieważ atom węgla wykazuje hybrydyzację sp3, jego budowa ma kształt tetraedru, a powstałe orbitale tworzą wraz z czterema atomami wodoru, równocenne wiązania.
Etan jest kolejnym w szeregu alkanem, którego wzór sumaryczny to C2H6. Zapisując wzór półstrukturalny H3C-CH3 można zauważyć, że z każdym z atomów węgla łączą się trzy atomy wodoru. Podobnie jak metan oraz inne niższe węglowodory, jest bezbarwnym oraz bezwonnym gazem. Wiązania C-H są typu czołowego sigma sp-s, natomiast wiązanie pojedyncze pomiędzy atomami węgla to wiązanie czołowe sigma sp-sp.
Synteza alkanów
- Uwodornienie alkenów lub alkinów

- Hydroliza związków Grignarda
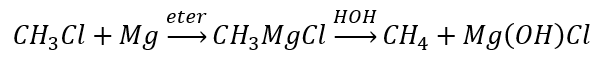
- Redukcja halogenków alkilowych
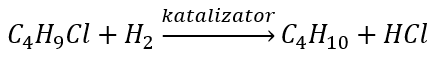
- Reakcja Wurtza
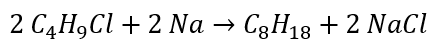
Redukcja aldehydów i ketonów
- Redukcja Clemmensena
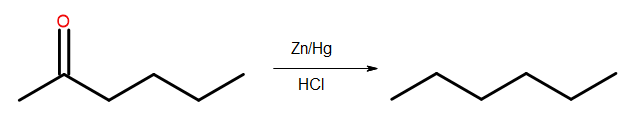
Rys. 4 Schemat redukcji Clemmensena
- Reakcja Wolffa-Kiżnera
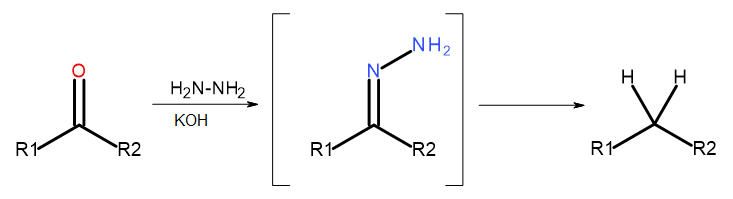
Rys. 5 Schemat redukcji Wolffa-Kiżnera
Właściwości fizykochemiczne alkanów
Krótkołańcuchowe alkany od C1 do C4 w temperaturze pokojowej są gazami. Natomiast inne homologi, od pentanu są cieczami o wzrastającej temperaturze wrzenia. Rozgałęzienia obecne w strukturach skutkują niższą temperaturą wrzenia izomerów. Zależność dodatku kolejnej grupy –CH2– w strukturze oraz temperatury wrzenia to około 20-30oC wyżej wraz ze wzrastaniem długości łańcucha węglowego. Stan skupienia alkanów od oktadekanu wzwyż to ciało stałe o temperaturach topnienia od 28oC dla n-oktadekanu. Stałe węglowodory to parafina, natomiast wyższe ciekłe to olej parafinowy.
Hydrofobowy charakter cząsteczek alkanów sprawia, że nie mieszają się one z wodą, nie są przez nią zwilżalne, ani się w niej nie rozpuszczają. Ich powinowactwo do cech niepolarnych sprawia natomiast, że łatwo rozpuszczają się same w sobie oraz w podobnych im niepolarnych, średnio- i nisko-polarnych rozpuszczalnikach organicznych. Rozpuszczalność alkanów w dwóch popularnych alkoholowych rozpuszczalnikach, to znaczy w metanolu oraz etanolu, jest stosunkowo dobra. W metanolu, alkany rozpuszczają się dobrze tylko do określonego stężenia. Po jego przekroczeniu występuje rozdzielanie się faz. W etanolu, niższe alkany rozpuszczają się bardzo łatwo, natomiast wyższe alkany nieco gorzej.
Wszystkie węglowodory stanowią substancje łatwopalne. Węglowodory, które są gazami, a także pary węglowodorów ciekłych tworzą mieszanki o potencjale wybuchowym w połączeniu z powietrzem.
Reaktywność alkanów jest stosunkowo niska, ze względu na brak potencjalnie reaktywnych grup funkcyjnych. Zarówno wiązania pomiędzy atomami węgla C-C, jak i te pomiędzy atomami węgla i wodoru C-H, są bardzo odporne na rozerwanie. Energie tych wiązań wynoszą kolejno 88 kcal/mol oraz 104 kcal/mol. Jedynie w określonych warunkach mogą reagować gwałtownie.
Reakcje alkanów
- Spalanie całkowite – z wydzieleniem dwutlenku węgla
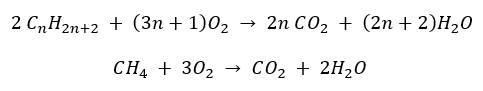
- Półspalanie – przy ograniczonym dostępie tlenu, z wydzieleniem tlenku węgla
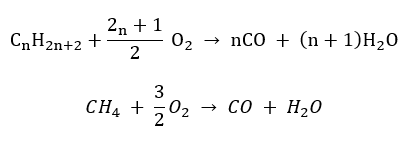
- Spalanie niecałkowite – przy bardzo ograniczonym dostępie tlenu, powstaje sadza
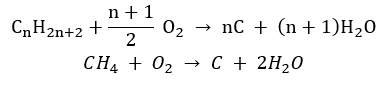
- Reakcja substytucji (halogenowanie rodnikowe – na przykładzie reakcji metanu z chlorem, przy udziale światła
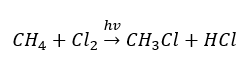
- Piroliza, czyli rozkład alkanów na mniejsze cząsteczki, pod wpływem bardzo wysokiej temperatury. W zależności od procesu, może nastąpić kraking, hydrokraking lub izomeryzacja.
- Nitrowanie z użyciem kwasu azotowego(V), z wytworzeniem mieszaniny produktów – izomerów, posiadających podstawnik –NO2 w różnych lokacjach.
- Sulfonowanie dwuetapowe, w którym produktem przejściowym są mersole, natomiast końcowym mersolany.
