Za roztok se považuje homogenní směs alespoň dvou látek. I když si pod pojmem roztok představujeme především kapalinu, jsou roztoky také plynné a pevné směsi. Přesto ve vodném prostředí probíhá velmi velká skupina chemických reakcí, jak v laboratorním, tak průmyslovém měřítku. Existují tři typy kapalných roztoků – rozpouštědlo je vždy kapalné, ale rozpuštěnou látkou může být plyn, kapalina nebo pevná látka. Mezi příklady patří vodné roztoky chlorovodíku, ethanolu a kuchyňské soli.

Popis složení roztoku
Nejdůležitější vlastností každého řešení je definice jeho složení. Schopnost určit složení roztoku a přepočítat jej v závislosti na zájmových jednotkách je základní dovedností každého chemika. Množství dané složky ve směsi může být definováno různými způsoby, např. hmotnostně, objemově nebo molárně. Z tohoto důvodu existuje také několik typů koncentrací, definujících závislost množství složky na množství roztoku nebo směsi. Nejčastěji při popisu složení roztoků používáme pojmy: hmotnostní zlomek, objemový zlomek, molární zlomek a molární koncentrace. Zlomky udávají, jakou část dané směsi tvoří ingredience zájmu. Mohou být vyjádřeny v jednotkách hmotnosti, objemu nebo molech sloučeniny.
Molární koncentrace
Toto je nejčastěji volená koncentrace z důvodu pohodlí použití stanovením počtu molů látky obsažené v objemu roztoku. Teoretickým základem je tvrzení, že roztoky dvou různých látek o stejné koncentraci a objemu, při stejné teplotě, obsahují stejný počet molů, a tedy i stejný počet molekul rozpuštěné látky. Na základě tohoto vztahu je možné pro roztoky se stejnými molárními koncentracemi míchat vhodné objemy roztoků pro dosažení správného podílu počtu molů určeného stechiometrickými koeficienty. To znamená, že pokud uvažujeme o reakcích typu A + B → C, kde jeden mol látky A reaguje s jedním molem látky B, musí se smíchat stejné objemy obou roztoků se stejnou molární koncentrací, aby reakce proběhla úplně. V případě reakce typu A + 2B → C, tj. jeden mol látky A reaguje se dvěma moly látky B, by měl být jeden objem roztoku A smíchán se dvěma objemy roztoku B. V tomto případě existuje i jiný roztok, protože místo použití ekvimolárních roztoků v objemovém poměru 1:2 lze použít jeden objem roztoku A a jeden objem roztoku B o dvojnásobné koncentraci. Molární koncentrace, označovaná C m , udává počet molů látek obsažených v objemové jednotce, nejčastěji v 1 dm 3 , roztoku. Vzorec umožňující výpočet molární koncentrace je podílem počtu molů látky (n s ) a celkového objemu roztoku (V sol ) v dm 3 : 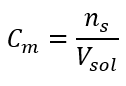 Při použití základní objemové jednotky podle soustavy SI, tj. metr krychlový, by se jako jednotka množství látky měly použít kilomoly. To však není zásadní výpočetní problém, protože
Při použití základní objemové jednotky podle soustavy SI, tj. metr krychlový, by se jako jednotka množství látky měly použít kilomoly. To však není zásadní výpočetní problém, protože 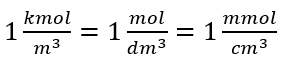 . Jednotka molární koncentrace C m je definována jako mol na decimetr krychlový, často se uvádí jako M. 1 mol/dm 3 = 1M
. Jednotka molární koncentrace C m je definována jako mol na decimetr krychlový, často se uvádí jako M. 1 mol/dm 3 = 1M 
Použití molární koncentrace
a) Výpočet molární koncentrace na základě obsahu složky v roztoku Příklad 1. Roztok obsahuje 30 g hydroxidu draselného ve 3,0 dm 3 roztoku. Vypočítejte jeho molární koncentraci. Krok 1. Výpočet molární hmotnosti KOH 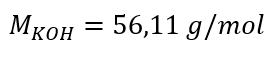 Krok 2. Výpočet počtu molů KOH v roztoku
Krok 2. Výpočet počtu molů KOH v roztoku 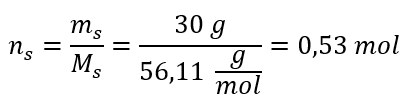 Krok 3. Výpočet molární koncentrace pomocí vzorce
Krok 3. Výpočet molární koncentrace pomocí vzorce 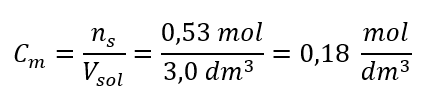 Odpověď: Molární koncentrace roztoku hydroxidu draselného obsahujícího 30 g látky ve 3,0 dm 3 roztoku je C m =
Odpověď: Molární koncentrace roztoku hydroxidu draselného obsahujícího 30 g látky ve 3,0 dm 3 roztoku je C m = 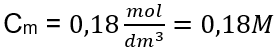 b) Příprava roztoku o dané koncentraci Příklad 2. Vypočítejte hmotnost glukózy (C 6 H 12 O 6 ) potřebnou pro přípravu 300 cm 3 roztoku o koncentraci 0,32 mol/dm 3 . Krok 1. Výpočet molární hmotnosti glukózy
b) Příprava roztoku o dané koncentraci Příklad 2. Vypočítejte hmotnost glukózy (C 6 H 12 O 6 ) potřebnou pro přípravu 300 cm 3 roztoku o koncentraci 0,32 mol/dm 3 . Krok 1. Výpočet molární hmotnosti glukózy 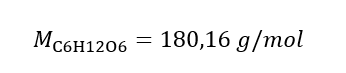 Krok 2. Výpočet potřebné hmotnosti glukózy pomocí převedeného molárního vzorce, s vědomím toho
Krok 2. Výpočet potřebné hmotnosti glukózy pomocí převedeného molárního vzorce, s vědomím toho 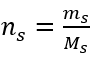 :
: 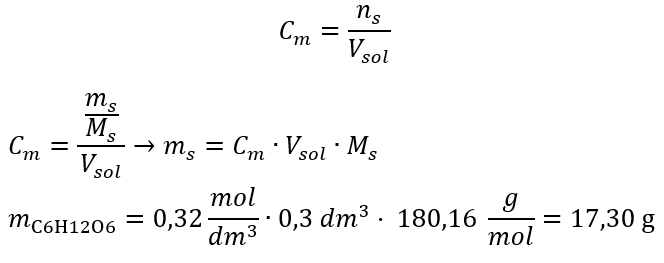 Po těchto výpočtech víme, že k přípravě takového roztoku by se mělo navážit 17,30 g glukózy a kvantitativně převést do odměrné baňky o objemu 300 cm3 . Odpověď: Pro přípravu 300 cm 3 roztoku glukózy o molární koncentraci 0,32 mol/dm 3 je třeba navážit 17,30 g látky. c) Ředění a koncentrace koncentrovaných roztoků Pomocí molární koncentrace můžeme také připravit roztok o dané koncentraci (C m2 ) zředěním koncentrovaného roztoku (C m1 ), kde:
Po těchto výpočtech víme, že k přípravě takového roztoku by se mělo navážit 17,30 g glukózy a kvantitativně převést do odměrné baňky o objemu 300 cm3 . Odpověď: Pro přípravu 300 cm 3 roztoku glukózy o molární koncentraci 0,32 mol/dm 3 je třeba navážit 17,30 g látky. c) Ředění a koncentrace koncentrovaných roztoků Pomocí molární koncentrace můžeme také připravit roztok o dané koncentraci (C m2 ) zředěním koncentrovaného roztoku (C m1 ), kde: 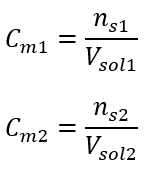 Při ředění se mění pouze objem roztoku, počet molů rozpuštěné látky zůstává nezměněn. Dá se tedy předpokládat, že:
Při ředění se mění pouze objem roztoku, počet molů rozpuštěné látky zůstává nezměněn. Dá se tedy předpokládat, že: ![]() Transformací vzorce pro molární koncentraci získáme následující vztahy:
Transformací vzorce pro molární koncentraci získáme následující vztahy: 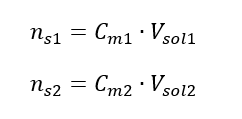 S vědomím, že dostaneme rovnici:
S vědomím, že dostaneme rovnici: 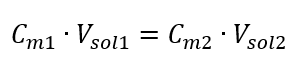 Vzorec pro ředění roztoků s uvážením molární koncentrace včetně nově získané (C mx ) lze označit jako:
Vzorec pro ředění roztoků s uvážením molární koncentrace včetně nově získané (C mx ) lze označit jako: 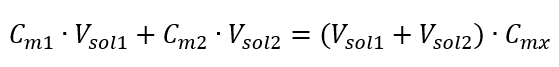 Příklad 3. Jaký objem kyseliny 0,150 mol/dm 3 lze získat zředěním 250 cm 3 roztoku této kyseliny o koncentraci 0,750 mol/dm 3 vodou? Krok 1. Transformace vzorce za předpokladu, že koncentrace vody je C m2 = 0 mol/dm 3 .
Příklad 3. Jaký objem kyseliny 0,150 mol/dm 3 lze získat zředěním 250 cm 3 roztoku této kyseliny o koncentraci 0,750 mol/dm 3 vodou? Krok 1. Transformace vzorce za předpokladu, že koncentrace vody je C m2 = 0 mol/dm 3 . 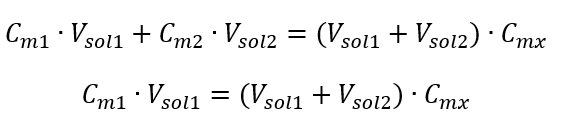 Krok 2. Výpočet celkového objemu (V x )
Krok 2. Výpočet celkového objemu (V x ) 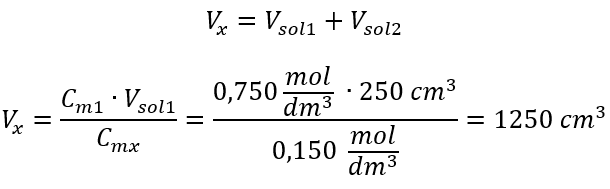 Alternativně lze použít vztahy stálosti počtu molů při ředění:
Alternativně lze použít vztahy stálosti počtu molů při ředění: 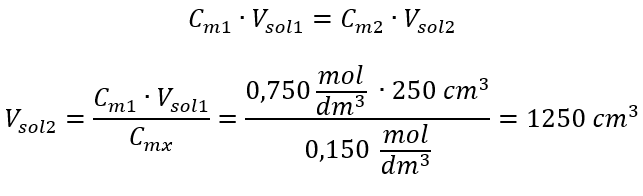 Odpověď: K naředění kyseliny na požadovanou koncentraci je třeba použít 1,25 dm 3 vody. Příklad 4. Vypočítejte, kolik vody se musí odpařit z 300 cm 3 roztoku o koncentraci 0,125 mol/dm 3 , abychom získali roztok o koncentraci 1,50 mol/dm 3 . Krok 1. Transformace vzorce pro změnu molární koncentrace za předpokladu, že molární koncentrace vody je C m2 = 0 mol/dm 3 .
Odpověď: K naředění kyseliny na požadovanou koncentraci je třeba použít 1,25 dm 3 vody. Příklad 4. Vypočítejte, kolik vody se musí odpařit z 300 cm 3 roztoku o koncentraci 0,125 mol/dm 3 , abychom získali roztok o koncentraci 1,50 mol/dm 3 . Krok 1. Transformace vzorce pro změnu molární koncentrace za předpokladu, že molární koncentrace vody je C m2 = 0 mol/dm 3 . 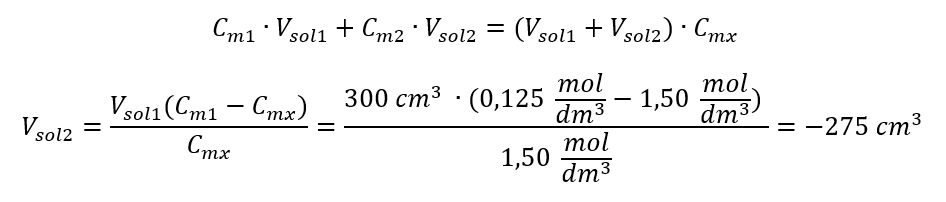 Odpověď: Aby se roztok koncentroval, musí se 275 odpařit. Přepočet molární koncentrace vs. procentuální koncentrace Při každodenní laboratorní práci je nutné převádět různé koncentrace roztoků. Nejčastěji se používá molární koncentrace a procentuální koncentrace. Je možné mezi nimi přepínat pomocí hustoty roztoku. Tento parametr musí být zaveden do vzorců pro sledované koncentrace:
Odpověď: Aby se roztok koncentroval, musí se 275 odpařit. Přepočet molární koncentrace vs. procentuální koncentrace Při každodenní laboratorní práci je nutné převádět různé koncentrace roztoků. Nejčastěji se používá molární koncentrace a procentuální koncentrace. Je možné mezi nimi přepínat pomocí hustoty roztoku. Tento parametr musí být zaveden do vzorců pro sledované koncentrace: 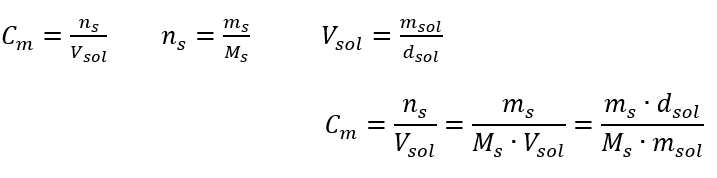 V transformaci můžeme vidět poměr hmotnosti látky k hmotnosti roztoku, který je základem procentuální koncentrace, vyjádřené vzorcem:
V transformaci můžeme vidět poměr hmotnosti látky k hmotnosti roztoku, který je základem procentuální koncentrace, vyjádřené vzorcem: 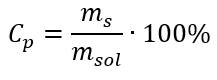 Dosazením vzorce pro procentuální koncentraci do dříve transformovaného vzorce pro molární koncentraci získáme vztah, který nám umožňuje volně přepínat mezi těmito dvěma hodnotami:
Dosazením vzorce pro procentuální koncentraci do dříve transformovaného vzorce pro molární koncentraci získáme vztah, který nám umožňuje volně přepínat mezi těmito dvěma hodnotami: 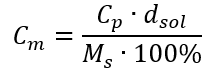 Jediným omezením vzorce je použití vhodných jednotek, proto je vhodné je brát v úvahu při všech výpočtech. Příklad 5. Vypočítejte molární koncentraci kyseliny sírové (VI) s vědomím, že její procentuální koncentrace je Cp = 98,0 %a její hustota je d = 1,84 kg/dm 3 . To lze vypočítat pomocí dvou metod: Metoda 1. V několika krocích, bez použití vzorce Krok 1. Výpočet hmotnosti 1,00 dm 3 kyseliny
Jediným omezením vzorce je použití vhodných jednotek, proto je vhodné je brát v úvahu při všech výpočtech. Příklad 5. Vypočítejte molární koncentraci kyseliny sírové (VI) s vědomím, že její procentuální koncentrace je Cp = 98,0 %a její hustota je d = 1,84 kg/dm 3 . To lze vypočítat pomocí dvou metod: Metoda 1. V několika krocích, bez použití vzorce Krok 1. Výpočet hmotnosti 1,00 dm 3 kyseliny 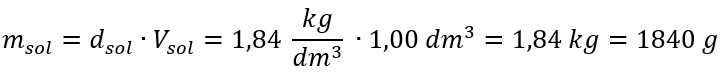 Krok 2. Výpočet hmotnosti kyseliny s přihlédnutím k procentuální koncentraci
Krok 2. Výpočet hmotnosti kyseliny s přihlédnutím k procentuální koncentraci 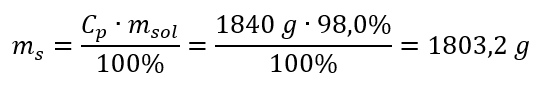 Krok 3. Výpočet počtu molů
Krok 3. Výpočet počtu molů 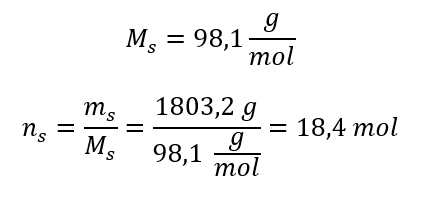 Krok 4. Výpočet molární koncentrace s vědomím, že je to počet molů látky v 1 dm 3 roztoku
Krok 4. Výpočet molární koncentrace s vědomím, že je to počet molů látky v 1 dm 3 roztoku 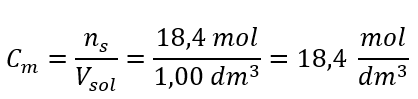 Metoda 2. Použití vztahu mezi procentuální koncentrací a molární koncentrací
Metoda 2. Použití vztahu mezi procentuální koncentrací a molární koncentrací 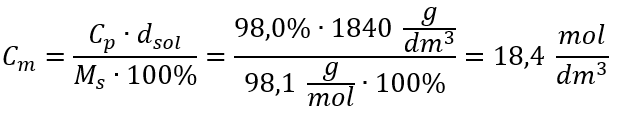 Odpověď: Molární koncentrace této kyseliny je 18,4 mol/dm 3 .
Odpověď: Molární koncentrace této kyseliny je 18,4 mol/dm 3 .

