Una miscela omogenea di almeno due sostanze è considerata una soluzione. Sebbene pensiamo a una soluzione principalmente come un liquido, anche le miscele gassose e solide sono soluzioni. Tuttavia, un gruppo molto ampio di reazioni chimiche, sia su scala di laboratorio che su scala industriale, si verifica in un ambiente acquoso. Esistono tre tipi di soluzioni liquide: il solvente è sempre liquido, ma il soluto può essere un gas, liquido o solido. Tra gli esempi vi sono soluzioni acquose di acido cloridrico, etanolo e sale da cucina.

Descrivere la composizione della soluzione
La caratteristica più importante di qualsiasi soluzione è la definizione della sua composizione. La capacità di determinare la composizione di una soluzione e di ricalcolarla in funzione delle unità di interesse è un’abilità fondamentale di ogni chimico. La quantità di un dato ingrediente in una miscela può essere definita in vari modi, ad esempio in massa, volume o molarità. Per questo motivo esistono anche diversi tipi di concentrazioni, che definiscono la dipendenza della quantità del componente dalla quantità della soluzione o della miscela. Molto spesso, quando descriviamo la composizione delle soluzioni, usiamo i termini: frazione di massa, frazione di volume, frazione molare e concentrazione molare. Le frazioni indicano quale parte di una data miscela rappresenta l’ingrediente di interesse. Possono essere espressi in unità di massa, volume o moli del composto.
Concentrazione molare
Questa è la concentrazione scelta più frequentemente, per comodità d’uso determinando il numero di moli della sostanza contenuta nel volume della soluzione. La base teorica è l’affermazione che le soluzioni di due sostanze diverse della stessa concentrazione e volume, alla stessa temperatura, contengono lo stesso numero di moli, e quindi lo stesso numero di molecole del soluto. Sulla base di questa relazione, per soluzioni con uguali concentrazioni molari è possibile miscelare opportuni volumi di soluzioni per ottenere la corretta proporzione del numero di moli determinato dai coefficienti stechiometrici. Ciò significa che, se si pensa alle reazioni di tipo A + B → C, in cui una mole di sostanza A reagisce con una mole di sostanza B, è necessario miscelare volumi uguali di entrambe le soluzioni con la stessa concentrazione molare affinché la reazione proceda completamente. Nel caso di una reazione di tipo A + 2B → C, cioè una mole di sostanza A reagisce con due moli di sostanza B, un volume di soluzione A dovrebbe essere miscelato con due volumi di soluzione B. In questo caso, c’è anche un’altra soluzione, perché invece di usare soluzioni equimolari in un rapporto volumetrico 1:2, si può usare un volume di soluzione A e un volume di soluzione B di concentrazione doppia. La concentrazione molare, indicata con C m , definisce il numero di moli di una sostanza contenuta in un’unità di volume, più spesso in 1 dm 3 , di una soluzione. La formula che permette di calcolare la concentrazione molare è il quoziente del numero di moli della sostanza (n s ) e del volume totale della soluzione (V sol ) in dm 3 : 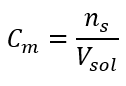 Utilizzando l’unità di base del volume secondo il sistema SI, cioè il metro cubo, le kilomoli dovrebbero essere usate come unità della quantità della sostanza. Tuttavia, questo non è un grosso problema computazionale, perché
Utilizzando l’unità di base del volume secondo il sistema SI, cioè il metro cubo, le kilomoli dovrebbero essere usate come unità della quantità della sostanza. Tuttavia, questo non è un grosso problema computazionale, perché 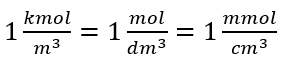 . L’unità di concentrazione molare C m è definita come mole per decimetro cubo, spesso indicato come M. 1 mol/dm 3 = 1M
. L’unità di concentrazione molare C m è definita come mole per decimetro cubo, spesso indicato come M. 1 mol/dm 3 = 1M 
L’uso della concentrazione molare
a) Calcolo della concentrazione molare in base al contenuto del componente nella soluzione Esempio 1. La soluzione contiene 30 g di idrossido di potassio in 3,0 dm 3 di soluzione. Calcola la sua concentrazione molare. Passaggio 1. Calcolo della massa molare di KOH 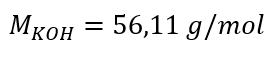 Passaggio 2. Calcolo del numero di moli di KOH nella soluzione
Passaggio 2. Calcolo del numero di moli di KOH nella soluzione 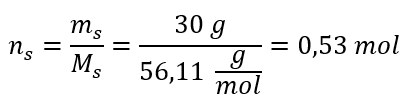 Passaggio 3. Calcolo della concentrazione molare utilizzando la formula
Passaggio 3. Calcolo della concentrazione molare utilizzando la formula 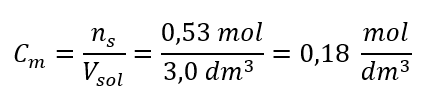 Risposta: La concentrazione molare di una soluzione di idrossido di potassio contenente 30 g della sostanza in 3,0 dm 3 della soluzione è C m =
Risposta: La concentrazione molare di una soluzione di idrossido di potassio contenente 30 g della sostanza in 3,0 dm 3 della soluzione è C m = 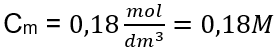 b) Preparazione di una soluzione con una data concentrazione Esempio 2. Calcolare la massa di glucosio (C 6 H 12 O 6 ) necessaria per la preparazione di 300 cm 3 di una soluzione con una concentrazione di 0,32 mol/dm 3 . Passaggio 1. Calcolo della massa molare del glucosio
b) Preparazione di una soluzione con una data concentrazione Esempio 2. Calcolare la massa di glucosio (C 6 H 12 O 6 ) necessaria per la preparazione di 300 cm 3 di una soluzione con una concentrazione di 0,32 mol/dm 3 . Passaggio 1. Calcolo della massa molare del glucosio 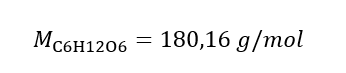 Passaggio 2. Calcolo della massa di glucosio necessaria, utilizzando la formula molare convertita, sapendolo
Passaggio 2. Calcolo della massa di glucosio necessaria, utilizzando la formula molare convertita, sapendolo 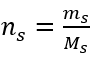 :
: 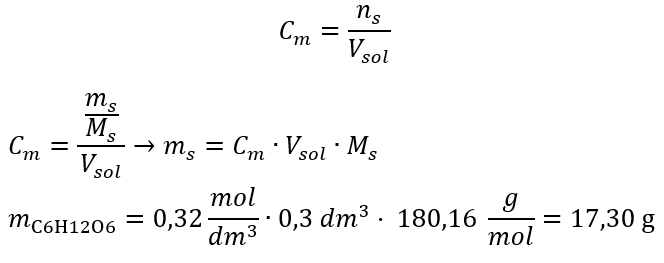 Dopo questi calcoli, sappiamo che per preparare una tale soluzione è necessario pesare 17,30 g di glucosio e trasferirli quantitativamente in un matraccio tarato da 300 cm 3 . Risposta: Per preparare 300 cm 3 di una soluzione di glucosio con una concentrazione molare di 0,32 mol/dm 3 , occorre pesare 17,30 g della sostanza. c) Diluizione e concentrazione di soluzioni concentrate Usando la concentrazione molare, possiamo anche preparare una soluzione di una data concentrazione (C m2 ) diluendo la soluzione concentrata (C m1 ), dove:
Dopo questi calcoli, sappiamo che per preparare una tale soluzione è necessario pesare 17,30 g di glucosio e trasferirli quantitativamente in un matraccio tarato da 300 cm 3 . Risposta: Per preparare 300 cm 3 di una soluzione di glucosio con una concentrazione molare di 0,32 mol/dm 3 , occorre pesare 17,30 g della sostanza. c) Diluizione e concentrazione di soluzioni concentrate Usando la concentrazione molare, possiamo anche preparare una soluzione di una data concentrazione (C m2 ) diluendo la soluzione concentrata (C m1 ), dove: 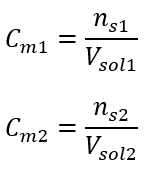 Durante la diluizione cambia solo il volume della soluzione, il numero di moli del soluto rimane invariato. Quindi si può supporre che:
Durante la diluizione cambia solo il volume della soluzione, il numero di moli del soluto rimane invariato. Quindi si può supporre che: ![]() Trasformando la formula per la concentrazione molare, otteniamo le seguenti relazioni:
Trasformando la formula per la concentrazione molare, otteniamo le seguenti relazioni: 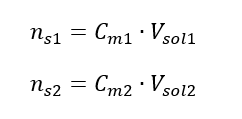 Sapendo che otteniamo l’equazione:
Sapendo che otteniamo l’equazione: 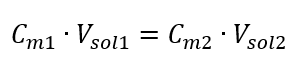 La formula per la diluizione delle soluzioni, tenendo conto della concentrazione molare, inclusa quella appena ottenuta (C mx ) può essere notata come:
La formula per la diluizione delle soluzioni, tenendo conto della concentrazione molare, inclusa quella appena ottenuta (C mx ) può essere notata come: 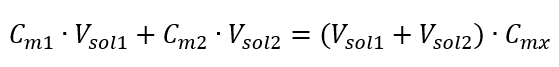 Esempio 3. Quale volume di acido 0,150 mol/dm 3 può essere ottenuto diluendo 250 cm 3 di una soluzione 0,750 mol/dm 3 di questo acido con acqua? Passaggio 1. Trasformazione della formula assumendo che la concentrazione dell’acqua sia C m2 = 0 mol/dm 3 .
Esempio 3. Quale volume di acido 0,150 mol/dm 3 può essere ottenuto diluendo 250 cm 3 di una soluzione 0,750 mol/dm 3 di questo acido con acqua? Passaggio 1. Trasformazione della formula assumendo che la concentrazione dell’acqua sia C m2 = 0 mol/dm 3 . 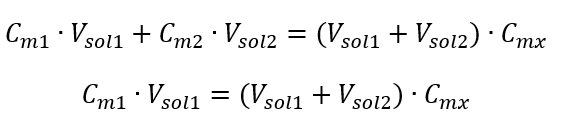 Passaggio 2. Calcolo del volume totale (V x )
Passaggio 2. Calcolo del volume totale (V x ) 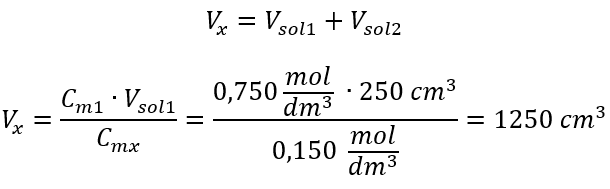 In alternativa si possono utilizzare le relazioni di permanenza del numero di moli durante la diluizione:
In alternativa si possono utilizzare le relazioni di permanenza del numero di moli durante la diluizione: 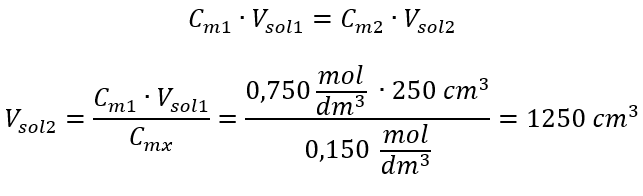 Risposta: Per diluire l’acido alla concentrazione richiesta, si devono usare 1,25 dm 3 di acqua. Esempio 4. Calcolare quanta acqua deve essere evaporata da 300 cm 3 di una soluzione con una concentrazione di 0.125 mol/dm 3 per ottenere una soluzione con una concentrazione di 1.50 mol/dm 3 . Passaggio 1. Trasformazione della formula per la variazione della concentrazione molare assumendo che la concentrazione molare dell’acqua sia C m2 = 0 mol/dm 3 .
Risposta: Per diluire l’acido alla concentrazione richiesta, si devono usare 1,25 dm 3 di acqua. Esempio 4. Calcolare quanta acqua deve essere evaporata da 300 cm 3 di una soluzione con una concentrazione di 0.125 mol/dm 3 per ottenere una soluzione con una concentrazione di 1.50 mol/dm 3 . Passaggio 1. Trasformazione della formula per la variazione della concentrazione molare assumendo che la concentrazione molare dell’acqua sia C m2 = 0 mol/dm 3 . 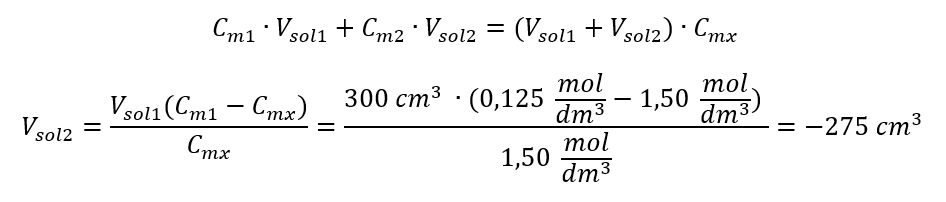 Risposta: Per concentrare la soluzione, 275 deve essere evaporato. La conversione della concentrazione molare rispetto alla concentrazione percentuale Nel lavoro di laboratorio quotidiano, è necessario convertire diverse concentrazioni di soluzioni. Molto spesso vengono utilizzate la concentrazione molare e la concentrazione percentuale. È possibile passare da uno all’altro utilizzando la densità della soluzione. Questo parametro deve essere introdotto nelle formule per le concentrazioni di interesse:
Risposta: Per concentrare la soluzione, 275 deve essere evaporato. La conversione della concentrazione molare rispetto alla concentrazione percentuale Nel lavoro di laboratorio quotidiano, è necessario convertire diverse concentrazioni di soluzioni. Molto spesso vengono utilizzate la concentrazione molare e la concentrazione percentuale. È possibile passare da uno all’altro utilizzando la densità della soluzione. Questo parametro deve essere introdotto nelle formule per le concentrazioni di interesse: 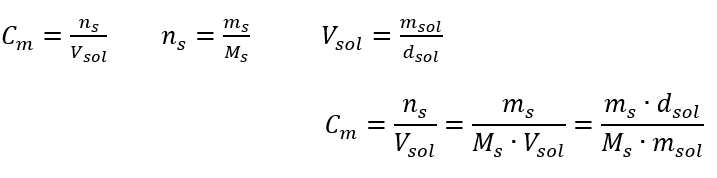 Nella trasformazione possiamo vedere il rapporto tra la massa della sostanza e la massa della soluzione, che è la base della concentrazione percentuale, espressa dalla formula:
Nella trasformazione possiamo vedere il rapporto tra la massa della sostanza e la massa della soluzione, che è la base della concentrazione percentuale, espressa dalla formula: 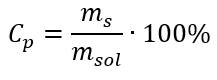 Sostituendo la formula per la concentrazione percentuale nella formula precedentemente trasformata per la concentrazione molare, otteniamo una relazione che ci permette di passare liberamente tra i due valori:
Sostituendo la formula per la concentrazione percentuale nella formula precedentemente trasformata per la concentrazione molare, otteniamo una relazione che ci permette di passare liberamente tra i due valori: 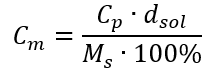 L’unica limitazione della formula è l’uso di unità appropriate, quindi vale la pena considerarle in tutti i calcoli. Esempio 5. Calcolare la concentrazione molare dell’acido solforico (VI) sapendo che la sua concentrazione percentuale è C p = 98,0%e la sua densità è d = 1,84 kg/dm 3 . Questo può essere calcolato utilizzando due metodi: Metodo 1. In pochi passaggi, senza utilizzare una formula Passaggio 1. Calcolo della massa di 1,00 dm 3 dell’acido
L’unica limitazione della formula è l’uso di unità appropriate, quindi vale la pena considerarle in tutti i calcoli. Esempio 5. Calcolare la concentrazione molare dell’acido solforico (VI) sapendo che la sua concentrazione percentuale è C p = 98,0%e la sua densità è d = 1,84 kg/dm 3 . Questo può essere calcolato utilizzando due metodi: Metodo 1. In pochi passaggi, senza utilizzare una formula Passaggio 1. Calcolo della massa di 1,00 dm 3 dell’acido 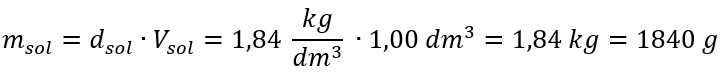 Passaggio 2. Calcolo della massa dell’acido tenendo conto della concentrazione percentuale
Passaggio 2. Calcolo della massa dell’acido tenendo conto della concentrazione percentuale 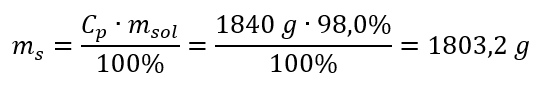 Passaggio 3. Calcolo del numero di moli
Passaggio 3. Calcolo del numero di moli 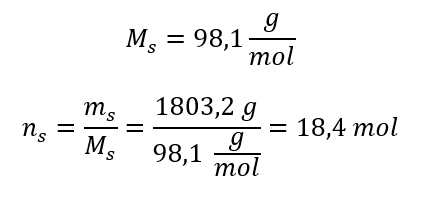 Passaggio 4. Calcolo della concentrazione molare sapendo che è il numero di moli della sostanza in 1 dm 3 della soluzione
Passaggio 4. Calcolo della concentrazione molare sapendo che è il numero di moli della sostanza in 1 dm 3 della soluzione 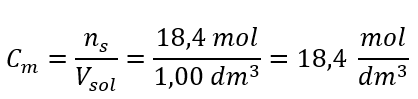 Metodo 2. Utilizzando la relazione tra concentrazione percentuale e concentrazione molare
Metodo 2. Utilizzando la relazione tra concentrazione percentuale e concentrazione molare 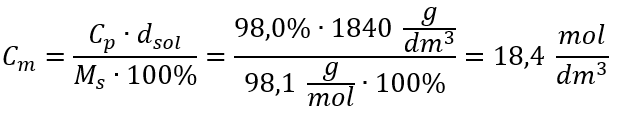 Risposta: La concentrazione molare di questo acido è 18,4 mol/dm 3 .
Risposta: La concentrazione molare di questo acido è 18,4 mol/dm 3 .

