Za roztok sa považuje homogénna zmes najmenej dvoch látok. Hoci si pod pojmom roztok predstavujeme najmä kvapalinu, roztokmi sú aj plynné a tuhé zmesi. Napriek tomu vo vodnom prostredí prebieha veľmi veľká skupina chemických reakcií v laboratórnom aj priemyselnom meradle. Existujú tri typy kvapalných roztokov - rozpúšťadlo je vždy kvapalné, ale rozpustená látka môže byť plyn, kvapalina alebo pevná látka. Medzi príklady patria vodné roztoky chlorovodíka, etanolu a kuchynskej soli.

Popis zloženia roztoku
Najdôležitejšou vlastnosťou každého riešenia je definícia jeho zloženia. Schopnosť určiť zloženie roztoku a prepočítať ho v závislosti od záujmových jednotiek je základnou zručnosťou každého chemika. Množstvo danej zložky v zmesi je možné definovať rôznymi spôsobmi, napr. hmotnosťou, objemom alebo molaritou. Z tohto dôvodu existuje aj niekoľko typov koncentrácií, ktoré definujú závislosť množstva zložky od množstva roztoku alebo zmesi. Najčastejšie pri popise zloženia roztokov používame pojmy: hmotnostný zlomok, objemový zlomok, molárny zlomok a molárna koncentrácia. Zlomky označujú, akú časť danej zmesi tvorí predmetná zložka. Môžu byť vyjadrené v jednotkách hmotnosti, objemu alebo móloch zlúčeniny.
Molárna koncentrácia
Toto je najčastejšie zvolená koncentrácia kvôli pohodlnosti použitia stanovením počtu mólov látky obsiahnutej v objeme roztoku. Teoretickým základom je tvrdenie, že roztoky dvoch rôznych látok rovnakej koncentrácie a objemu, pri rovnakej teplote, obsahujú rovnaký počet mólov, a teda rovnaký počet molekúl rozpustenej látky. Na základe tohto vzťahu je možné pre roztoky s rovnakými molárnymi koncentráciami zmiešať vhodné objemy roztokov, aby sa dosiahol správny pomer počtu mólov určeného stechiometrickými koeficientmi. To znamená, že ak uvažujeme o reakciách typu A + B → C, kde jeden mól látky A reaguje s jedným mólom látky B, musia sa zmiešať rovnaké objemy oboch roztokov s rovnakou molárnou koncentráciou, aby reakcia prebehla úplne. V prípade reakcie typu A + 2B → C, tj jeden mól látky A reaguje s dvoma mólmi látky B, by sa mal jeden objem roztoku A zmiešať s dvoma objemami roztoku B. V tomto prípade existuje aj iné riešenie, pretože namiesto použitia ekvimolárnych roztokov v objemovom pomere 1:2 možno použiť jeden objem roztoku A a jeden objem roztoku B s dvojnásobnou koncentráciou. Molárna koncentrácia, označovaná ako C m , udáva počet mólov látky obsiahnutej v objemovej jednotke, najčastejšie v 1 dm 3 roztoku. Vzorec umožňujúci výpočet molárnej koncentrácie je podielom počtu mólov látky ( ns ) a celkového objemu roztoku (V sol ) v dm 3 : 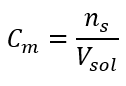 Pri použití základnej objemovej jednotky podľa sústavy SI, tj meter kubický, by sa ako jednotka množstva látky mali použiť kilomóly. To však nie je veľký výpočtový problém, pretože
Pri použití základnej objemovej jednotky podľa sústavy SI, tj meter kubický, by sa ako jednotka množstva látky mali použiť kilomóly. To však nie je veľký výpočtový problém, pretože 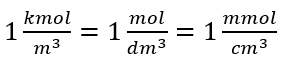 . Jednotka molárnej koncentrácie C m je definovaná ako mól na decimeter kubický, často označovaný ako M. 1 mol/dm 3 = 1M
. Jednotka molárnej koncentrácie C m je definovaná ako mól na decimeter kubický, často označovaný ako M. 1 mol/dm 3 = 1M 
Použitie molárnej koncentrácie
a) Výpočet molárnej koncentrácie na základe obsahu zložky v roztoku Príklad 1. Roztok obsahuje 30 g hydroxidu draselného v 3,0 dm 3 roztoku. Vypočítajte jeho molárnu koncentráciu. Krok 1. Výpočet molárnej hmotnosti KOH 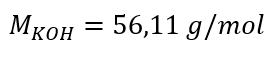 Krok 2. Výpočet počtu mólov KOH v roztoku
Krok 2. Výpočet počtu mólov KOH v roztoku 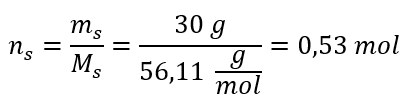 Krok 3. Výpočet molárnej koncentrácie pomocou vzorca
Krok 3. Výpočet molárnej koncentrácie pomocou vzorca 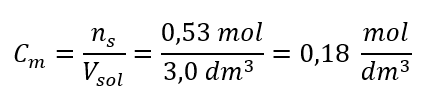 Odpoveď: Molárna koncentrácia roztoku hydroxidu draselného s obsahom 30 g látky v 3,0 dm 3 roztoku je C m =
Odpoveď: Molárna koncentrácia roztoku hydroxidu draselného s obsahom 30 g látky v 3,0 dm 3 roztoku je C m = 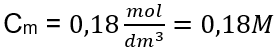 b) Príprava roztoku s danou koncentráciou Príklad 2. Vypočítajte hmotnosť glukózy (C 6 H 12 O 6 ) potrebnú na prípravu 300 cm 3 roztoku s koncentráciou 0,32 mol/dm 3 . Krok 1. Výpočet molárnej hmotnosti glukózy
b) Príprava roztoku s danou koncentráciou Príklad 2. Vypočítajte hmotnosť glukózy (C 6 H 12 O 6 ) potrebnú na prípravu 300 cm 3 roztoku s koncentráciou 0,32 mol/dm 3 . Krok 1. Výpočet molárnej hmotnosti glukózy 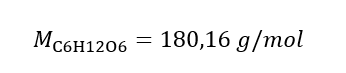 Krok 2. Výpočet potrebnej hmotnosti glukózy pomocou prevedeného molárneho vzorca, ak to viete
Krok 2. Výpočet potrebnej hmotnosti glukózy pomocou prevedeného molárneho vzorca, ak to viete 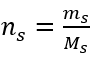 :
: 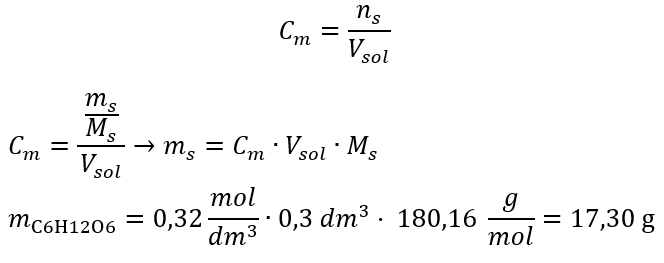 Po týchto výpočtoch vieme, že na prípravu takéhoto roztoku by sa malo odvážiť 17,30 g glukózy a kvantitatívne preniesť do odmernej banky s objemom 300 cm3 . Odpoveď: Na prípravu 300 cm 3 roztoku glukózy s molárnou koncentráciou 0,32 mol/dm 3 treba navážiť 17,30 g látky. c) Riedenie a zahusťovanie koncentrovaných roztokov Pomocou molárnej koncentrácie môžeme pripraviť roztok danej koncentrácie (C m2 ) aj zriedením koncentrovaného roztoku (C m1 ), kde:
Po týchto výpočtoch vieme, že na prípravu takéhoto roztoku by sa malo odvážiť 17,30 g glukózy a kvantitatívne preniesť do odmernej banky s objemom 300 cm3 . Odpoveď: Na prípravu 300 cm 3 roztoku glukózy s molárnou koncentráciou 0,32 mol/dm 3 treba navážiť 17,30 g látky. c) Riedenie a zahusťovanie koncentrovaných roztokov Pomocou molárnej koncentrácie môžeme pripraviť roztok danej koncentrácie (C m2 ) aj zriedením koncentrovaného roztoku (C m1 ), kde: 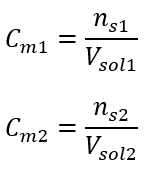 Pri riedení sa mení len objem roztoku, počet mólov rozpustenej látky zostáva nezmenený. Dá sa teda predpokladať, že:
Pri riedení sa mení len objem roztoku, počet mólov rozpustenej látky zostáva nezmenený. Dá sa teda predpokladať, že: ![]() Transformáciou vzorca pre molárnu koncentráciu získame nasledujúce vzťahy:
Transformáciou vzorca pre molárnu koncentráciu získame nasledujúce vzťahy: 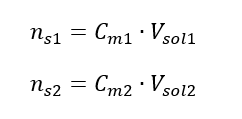 Keď vieme, že dostaneme rovnicu:
Keď vieme, že dostaneme rovnicu: 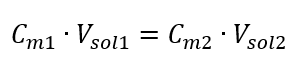 Vzorec na riedenie roztokov s ohľadom na molárnu koncentráciu vrátane novo získanej (C mx ) možno označiť ako:
Vzorec na riedenie roztokov s ohľadom na molárnu koncentráciu vrátane novo získanej (C mx ) možno označiť ako: 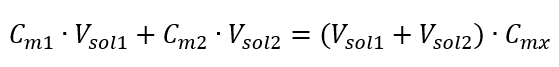 Príklad 3. Aký objem 0,150 mol/dm 3 kyseliny možno získať zriedením 250 cm 3 0,750 mol/dm 3 roztoku tejto kyseliny vodou? Krok 1. Transformácia vzorca za predpokladu, že koncentrácia vody je C m2 = 0 mol/dm 3 .
Príklad 3. Aký objem 0,150 mol/dm 3 kyseliny možno získať zriedením 250 cm 3 0,750 mol/dm 3 roztoku tejto kyseliny vodou? Krok 1. Transformácia vzorca za predpokladu, že koncentrácia vody je C m2 = 0 mol/dm 3 . 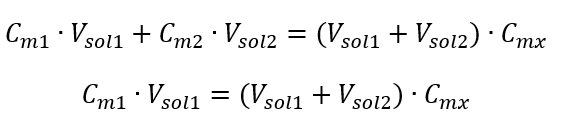 Krok 2. Výpočet celkového objemu (V x )
Krok 2. Výpočet celkového objemu (V x ) 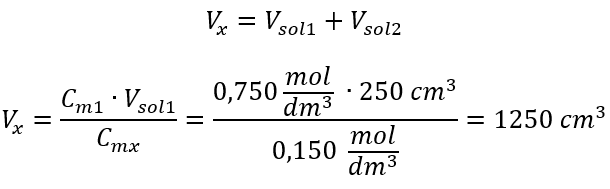 Alternatívne možno použiť vzťahy stálosti počtu mólov počas riedenia:
Alternatívne možno použiť vzťahy stálosti počtu mólov počas riedenia: 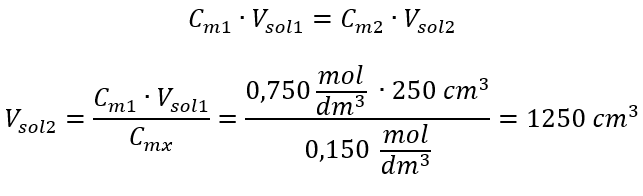 Odpoveď: Na zriedenie kyseliny na požadovanú koncentráciu je potrebné použiť 1,25 dm 3 vody. Príklad 4. Vypočítajte, koľko vody sa musí odpariť z 300 cm 3 roztoku s koncentráciou 0,125 mol/dm 3 , aby sa získal roztok s koncentráciou 1,50 mol/dm 3 . Krok 1. Transformácia vzorca pre zmenu molárnej koncentrácie za predpokladu, že molárna koncentrácia vody je C m2 = 0 mol/dm 3 .
Odpoveď: Na zriedenie kyseliny na požadovanú koncentráciu je potrebné použiť 1,25 dm 3 vody. Príklad 4. Vypočítajte, koľko vody sa musí odpariť z 300 cm 3 roztoku s koncentráciou 0,125 mol/dm 3 , aby sa získal roztok s koncentráciou 1,50 mol/dm 3 . Krok 1. Transformácia vzorca pre zmenu molárnej koncentrácie za predpokladu, že molárna koncentrácia vody je C m2 = 0 mol/dm 3 . 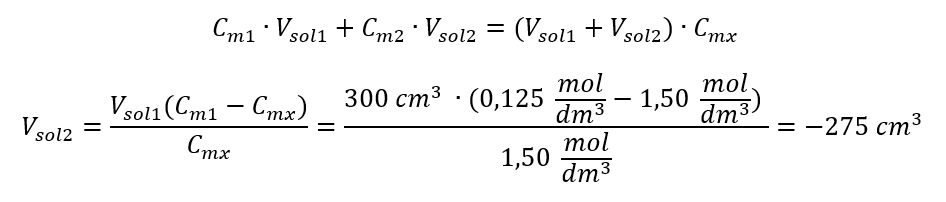 Odpoveď: Na zahustenie roztoku sa musí 275 odpariť. Prepočet molárnej koncentrácie vs. percentuálna koncentrácia Pri každodennej laboratórnej práci je potrebné previesť rôzne koncentrácie roztokov. Najčastejšie sa používa molárna koncentrácia a percentuálna koncentrácia. Je možné medzi nimi prepínať pomocou hustoty roztoku. Tento parameter sa musí zaviesť do vzorcov pre koncentrácie záujmu:
Odpoveď: Na zahustenie roztoku sa musí 275 odpariť. Prepočet molárnej koncentrácie vs. percentuálna koncentrácia Pri každodennej laboratórnej práci je potrebné previesť rôzne koncentrácie roztokov. Najčastejšie sa používa molárna koncentrácia a percentuálna koncentrácia. Je možné medzi nimi prepínať pomocou hustoty roztoku. Tento parameter sa musí zaviesť do vzorcov pre koncentrácie záujmu: 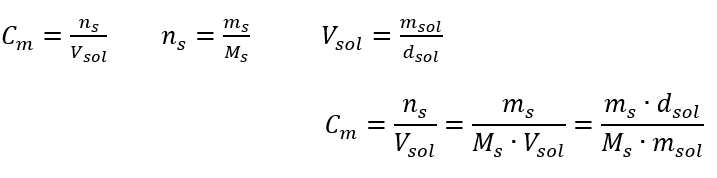 Pri transformácii vidíme pomer hmotnosti látky k hmotnosti roztoku, ktorý je základom percentuálnej koncentrácie vyjadrenej vzorcom:
Pri transformácii vidíme pomer hmotnosti látky k hmotnosti roztoku, ktorý je základom percentuálnej koncentrácie vyjadrenej vzorcom: 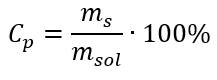 Nahradením vzorca pre percentuálnu koncentráciu do predtým transformovaného vzorca pre molárnu koncentráciu dostaneme vzťah, ktorý nám umožňuje voľne prepínať medzi týmito dvoma hodnotami:
Nahradením vzorca pre percentuálnu koncentráciu do predtým transformovaného vzorca pre molárnu koncentráciu dostaneme vzťah, ktorý nám umožňuje voľne prepínať medzi týmito dvoma hodnotami: 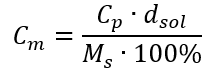 Jediným obmedzením vzorca je použitie vhodných jednotiek, preto sa oplatí ich brať do úvahy pri všetkých výpočtoch. Príklad 5. Vypočítajte molárnu koncentráciu kyseliny sírovej (VI) s vedomím, že jej percentuálna koncentrácia je Cp = 98,0 %a jej hustota je d = 1,84 kg/dm 3 . To možno vypočítať pomocou dvoch metód: Metóda 1. V niekoľkých krokoch, bez použitia vzorca Krok 1. Výpočet hmotnosti 1,00 dm 3 kyseliny
Jediným obmedzením vzorca je použitie vhodných jednotiek, preto sa oplatí ich brať do úvahy pri všetkých výpočtoch. Príklad 5. Vypočítajte molárnu koncentráciu kyseliny sírovej (VI) s vedomím, že jej percentuálna koncentrácia je Cp = 98,0 %a jej hustota je d = 1,84 kg/dm 3 . To možno vypočítať pomocou dvoch metód: Metóda 1. V niekoľkých krokoch, bez použitia vzorca Krok 1. Výpočet hmotnosti 1,00 dm 3 kyseliny 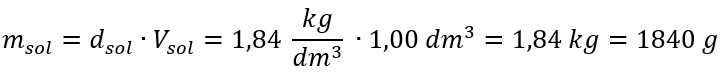 Krok 2. Výpočet hmotnosti kyseliny s prihliadnutím na percentuálnu koncentráciu
Krok 2. Výpočet hmotnosti kyseliny s prihliadnutím na percentuálnu koncentráciu 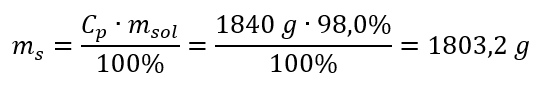 Krok 3. Výpočet počtu mólov
Krok 3. Výpočet počtu mólov 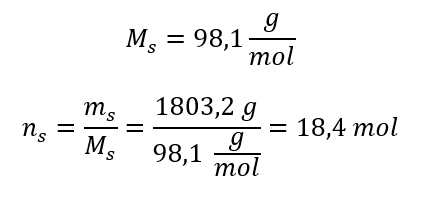 Krok 4. Výpočet molárnej koncentrácie s vedomím, že je to počet mólov látky v 1 dm 3 roztoku
Krok 4. Výpočet molárnej koncentrácie s vedomím, že je to počet mólov látky v 1 dm 3 roztoku 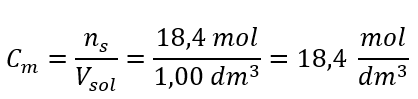 Metóda 2. Použitie vzťahu medzi percentuálnou koncentráciou a molárnou koncentráciou
Metóda 2. Použitie vzťahu medzi percentuálnou koncentráciou a molárnou koncentráciou 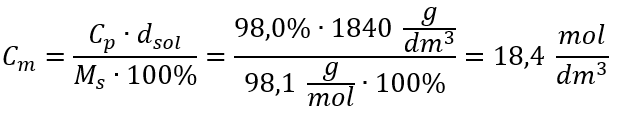 Odpoveď: Molárna koncentrácia tejto kyseliny je 18,4 mol/dm 3 .
Odpoveď: Molárna koncentrácia tejto kyseliny je 18,4 mol/dm 3 .

