Een homogeen mengsel van ten minste twee stoffen wordt als een oplossing beschouwd. Hoewel we bij een oplossing vooral denken aan een vloeistof, zijn gasvormige en vaste mengsels ook oplossingen. Niettemin vindt een zeer grote groep chemische reacties, zowel op laboratorium- als op industriële schaal, plaats in een waterige omgeving. Er zijn drie soorten vloeibare oplossingen: het oplosmiddel is altijd vloeibaar, maar de opgeloste stof kan een gas, vloeistof of vaste stof zijn. Voorbeelden zijn waterige oplossingen van waterstofchloride, ethanol en keukenzout.

Beschrijving van de samenstelling van de oplossing
Het belangrijkste kenmerk van elke oplossing is de definitie van de samenstelling. Het vermogen om de samenstelling van een oplossing te bepalen en deze te herberekenen afhankelijk van de eenheden die van belang zijn, is een basisvaardigheid van elke chemicus. De hoeveelheid van een bepaald ingrediënt in een mengsel kan op verschillende manieren worden gedefinieerd, bijvoorbeeld door massa, volume of molariteit. Om deze reden zijn er ook verschillende soorten concentraties, die de afhankelijkheid van de hoeveelheid van de component van de hoeveelheid oplossing of mengsel bepalen. Meestal gebruiken we bij het beschrijven van de samenstelling van oplossingen de termen: massafractie, volumefractie, molfractie en molaire concentratie. Breuken geven aan welk deel van een bepaald mengsel het betreffende ingrediënt vertegenwoordigt. Ze kunnen worden uitgedrukt in eenheden van massa, volume of molen van de verbinding.
Molaire concentratie
Dit is de meest gekozen concentratie vanwege het gebruiksgemak door het aantal mol van de stof in het volume van de oplossing te bepalen. De theoretische basis is de bewering dat oplossingen van twee verschillende stoffen met dezelfde concentratie en hetzelfde volume, bij dezelfde temperatuur, hetzelfde aantal mol bevatten, en dus hetzelfde aantal moleculen van de opgeloste stof. Op basis van deze relatie is het voor oplossingen met gelijke molaire concentraties mogelijk om geschikte volumes oplossingen te mengen om de juiste verhouding van het aantal mol bepaald door de stoichiometrische coëfficiënten te bereiken. Dit betekent dat, als we denken aan reacties van het type A + B → C, waarbij één mol stof A reageert met één mol stof B, gelijke volumes van beide oplossingen met dezelfde molaire concentratie moeten worden gemengd om de reactie volledig te laten verlopen. In het geval van een reactie van het type A + 2B → C, dwz één mol stof A reageert met twee mol stof B, moet één volume oplossing A worden gemengd met twee volumes oplossing B. In dit geval is er ook een andere oplossing, want in plaats van equimolaire oplossingen in een volumeverhouding van 1:2 te gebruiken, kan men één volume oplossing A en één volume oplossing B met tweemaal de concentratie gebruiken. Molaire concentratie, aangeduid met C m , definieert het aantal molen van een stof in een volume-eenheid, meestal in 1 dm 3 , van een oplossing. De formule die de berekening van de molaire concentratie mogelijk maakt, is het quotiënt van het aantal mol van de stof ( ns ) en het totale volume van de oplossing (V sol ) in dm 3 : 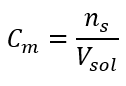 Gebruikmakend van de basisvolume-eenheid volgens het SI-systeem, dwz kubieke meter, moet kilomol worden gebruikt als eenheid voor de hoeveelheid van de stof. Dit is echter geen groot rekenprobleem, omdat
Gebruikmakend van de basisvolume-eenheid volgens het SI-systeem, dwz kubieke meter, moet kilomol worden gebruikt als eenheid voor de hoeveelheid van de stof. Dit is echter geen groot rekenprobleem, omdat 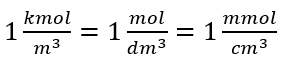 . De eenheid van molaire concentratie C m wordt gedefinieerd als mol per kubieke decimeter, vaak genoteerd als M. 1 mol/dm 3 = 1M
. De eenheid van molaire concentratie C m wordt gedefinieerd als mol per kubieke decimeter, vaak genoteerd als M. 1 mol/dm 3 = 1M 
Het gebruik van molaire concentratie
a) Berekening van de molaire concentratie op basis van het gehalte van de component in de oplossing Voorbeeld 1. De oplossing bevat 30 g kaliumhydroxide in 3,0 dm3 oplossing. Bereken de molaire concentratie ervan. Stap 1. Berekening van de molaire massa van KOH 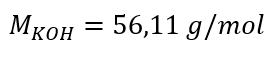 Stap 2. Berekening van het aantal molen KOH in de oplossing
Stap 2. Berekening van het aantal molen KOH in de oplossing 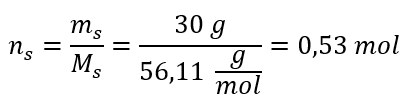 Stap 3. Berekening van de molaire concentratie met behulp van de formule
Stap 3. Berekening van de molaire concentratie met behulp van de formule 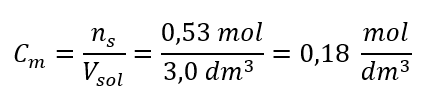 Antwoord: De molaire concentratie van een kaliumhydroxideoplossing die 30 g van de stof bevat in 3,0 dm 3 oplossing is C m =
Antwoord: De molaire concentratie van een kaliumhydroxideoplossing die 30 g van de stof bevat in 3,0 dm 3 oplossing is C m = 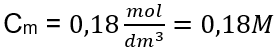 b) Bereiding van een oplossing met een bepaalde concentratie Voorbeeld 2. Bereken de massa glucose ( C6H1206 ) die nodig is voor de bereiding van 300 cm3 van een oplossing met een concentratie van 0,32 mol/ dm3 . Stap 1. Berekening van de molaire massa van glucose
b) Bereiding van een oplossing met een bepaalde concentratie Voorbeeld 2. Bereken de massa glucose ( C6H1206 ) die nodig is voor de bereiding van 300 cm3 van een oplossing met een concentratie van 0,32 mol/ dm3 . Stap 1. Berekening van de molaire massa van glucose 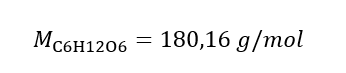 Stap 2. Berekening van de benodigde massa glucose, gebruikmakend van de omgerekende molaire formule, wetende dat
Stap 2. Berekening van de benodigde massa glucose, gebruikmakend van de omgerekende molaire formule, wetende dat 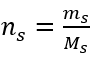 :
: 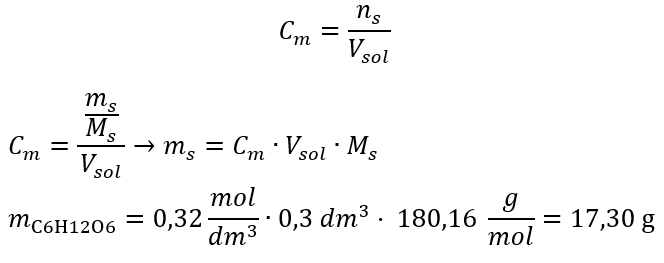 Na deze berekeningen weten we dat om een dergelijke oplossing te bereiden, 17,30 g glucose moet worden gewogen en kwantitatief moet worden overgebracht in een maatkolf van 300 cm3 . Antwoord: Om 300 cm 3 van een glucose-oplossing met een molaire concentratie van 0,32 mol/dm 3 te bereiden, moet 17,30 g van de stof worden gewogen. c) Verdunning en concentratie van geconcentreerde oplossingen Met behulp van de molaire concentratie kunnen we ook een oplossing met een bepaalde concentratie (C m2 ) bereiden door de geconcentreerde oplossing (C m1 ) te verdunnen, waarbij:
Na deze berekeningen weten we dat om een dergelijke oplossing te bereiden, 17,30 g glucose moet worden gewogen en kwantitatief moet worden overgebracht in een maatkolf van 300 cm3 . Antwoord: Om 300 cm 3 van een glucose-oplossing met een molaire concentratie van 0,32 mol/dm 3 te bereiden, moet 17,30 g van de stof worden gewogen. c) Verdunning en concentratie van geconcentreerde oplossingen Met behulp van de molaire concentratie kunnen we ook een oplossing met een bepaalde concentratie (C m2 ) bereiden door de geconcentreerde oplossing (C m1 ) te verdunnen, waarbij: 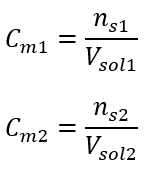 Tijdens verdunning verandert alleen het volume van de oplossing, het aantal mol opgeloste stof blijft ongewijzigd. Men mag dus aannemen dat:
Tijdens verdunning verandert alleen het volume van de oplossing, het aantal mol opgeloste stof blijft ongewijzigd. Men mag dus aannemen dat: ![]() Door de formule voor molaire concentratie te transformeren, verkrijgen we de volgende relaties:
Door de formule voor molaire concentratie te transformeren, verkrijgen we de volgende relaties: 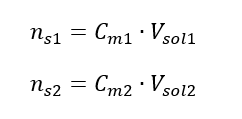 Wetende dat we de vergelijking krijgen:
Wetende dat we de vergelijking krijgen: 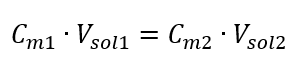 De formule voor de verdunning van oplossingen, rekening houdend met de molaire concentratie, inclusief de nieuw verkregen ( Cmx ) kan worden genoteerd als:
De formule voor de verdunning van oplossingen, rekening houdend met de molaire concentratie, inclusief de nieuw verkregen ( Cmx ) kan worden genoteerd als: 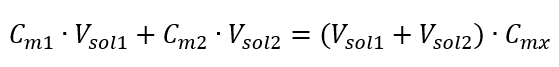 Voorbeeld 3. Welk volume van 0,150 mol/dm 3 zuur kan worden verkregen door 250 cm 3 van een 0,750 mol/dm 3 oplossing van dit zuur te verdunnen met water? Stap 1. Transformatie van de formule met de aanname dat de waterconcentratie C m2 = 0 mol/dm 3 is.
Voorbeeld 3. Welk volume van 0,150 mol/dm 3 zuur kan worden verkregen door 250 cm 3 van een 0,750 mol/dm 3 oplossing van dit zuur te verdunnen met water? Stap 1. Transformatie van de formule met de aanname dat de waterconcentratie C m2 = 0 mol/dm 3 is. 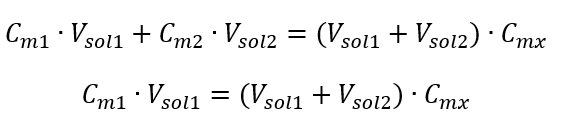 Stap 2. Berekening totaal volume (V x )
Stap 2. Berekening totaal volume (V x ) 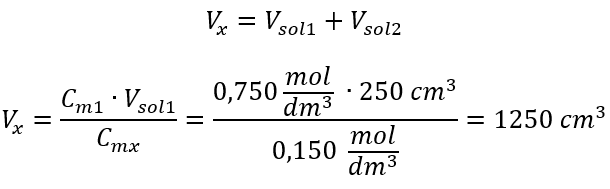 Als alternatief kunnen de relaties van duurzaamheid van het aantal mol tijdens verdunning worden gebruikt:
Als alternatief kunnen de relaties van duurzaamheid van het aantal mol tijdens verdunning worden gebruikt: 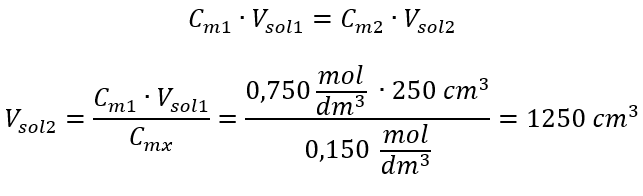 Antwoord: Om het zuur tot de gewenste concentratie te verdunnen, moet 1,25 dm 3 water worden gebruikt. Voorbeeld 4. Bereken hoeveel water uit 300 cm 3 van een oplossing met een concentratie van 0,125 mol/dm 3 moet worden verdampt om een oplossing met een concentratie van 1,50 mol/dm 3 te verkrijgen. Stap 1. Transformatie van de formule voor de verandering in molaire concentratie met de aanname dat de molaire concentratie van water C m2 = 0 mol/dm 3 is.
Antwoord: Om het zuur tot de gewenste concentratie te verdunnen, moet 1,25 dm 3 water worden gebruikt. Voorbeeld 4. Bereken hoeveel water uit 300 cm 3 van een oplossing met een concentratie van 0,125 mol/dm 3 moet worden verdampt om een oplossing met een concentratie van 1,50 mol/dm 3 te verkrijgen. Stap 1. Transformatie van de formule voor de verandering in molaire concentratie met de aanname dat de molaire concentratie van water C m2 = 0 mol/dm 3 is. 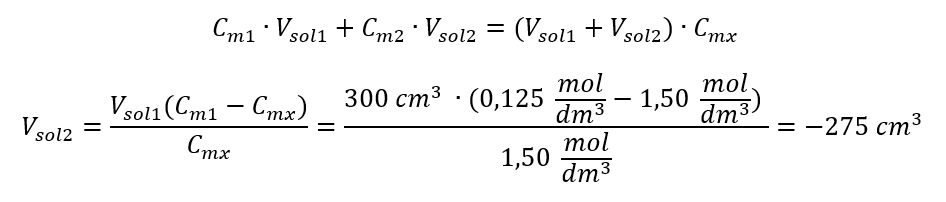 Antwoord: Om de oplossing te concentreren moet 275 worden verdampt. De conversie van molaire concentratie vs. procentuele concentratie In het dagelijkse laboratoriumwerk is het noodzakelijk om verschillende concentraties van oplossingen om te rekenen. Meestal worden molaire concentratie en procentuele concentratie gebruikt. Het is mogelijk om hiertussen te schakelen met behulp van de dichtheid van de oplossing. Deze parameter moet worden geïntroduceerd in de formules voor de concentraties van belang:
Antwoord: Om de oplossing te concentreren moet 275 worden verdampt. De conversie van molaire concentratie vs. procentuele concentratie In het dagelijkse laboratoriumwerk is het noodzakelijk om verschillende concentraties van oplossingen om te rekenen. Meestal worden molaire concentratie en procentuele concentratie gebruikt. Het is mogelijk om hiertussen te schakelen met behulp van de dichtheid van de oplossing. Deze parameter moet worden geïntroduceerd in de formules voor de concentraties van belang: 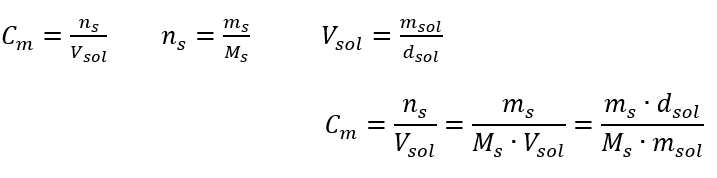 In de transformatie kunnen we de verhouding van de stofmassa tot de massa van de oplossing zien, wat de basis is van de procentuele concentratie, uitgedrukt door de formule:
In de transformatie kunnen we de verhouding van de stofmassa tot de massa van de oplossing zien, wat de basis is van de procentuele concentratie, uitgedrukt door de formule: 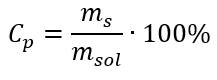 Als we de formule voor de procentuele concentratie vervangen door de eerder getransformeerde formule voor de molaire concentratie, krijgen we een relatie waarmee we vrij kunnen schakelen tussen de twee waarden:
Als we de formule voor de procentuele concentratie vervangen door de eerder getransformeerde formule voor de molaire concentratie, krijgen we een relatie waarmee we vrij kunnen schakelen tussen de twee waarden: 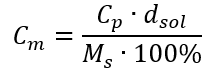 De enige beperking van de formule is het gebruik van geschikte eenheden, dus het is de moeite waard om ze in alle berekeningen te overwegen. Voorbeeld 5. Bereken de molaire concentratie van zwavelzuur (VI) wetende dat het concentratiepercentage Cp = 98,0%is en de dichtheid d = 1,84 kg/ dm3 . Dit kan op twee manieren worden berekend: Methode 1. In een paar stappen, zonder een formule te gebruiken Stap 1. Berekening van de massa van 1,00 dm 3 van het zuur
De enige beperking van de formule is het gebruik van geschikte eenheden, dus het is de moeite waard om ze in alle berekeningen te overwegen. Voorbeeld 5. Bereken de molaire concentratie van zwavelzuur (VI) wetende dat het concentratiepercentage Cp = 98,0%is en de dichtheid d = 1,84 kg/ dm3 . Dit kan op twee manieren worden berekend: Methode 1. In een paar stappen, zonder een formule te gebruiken Stap 1. Berekening van de massa van 1,00 dm 3 van het zuur 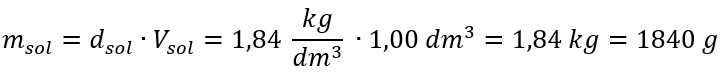 Stap 2. Berekening van de massa van het zuur rekening houdend met de procentuele concentratie
Stap 2. Berekening van de massa van het zuur rekening houdend met de procentuele concentratie 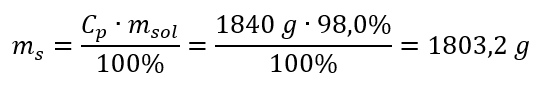 Stap 3. Berekening van het aantal mol
Stap 3. Berekening van het aantal mol 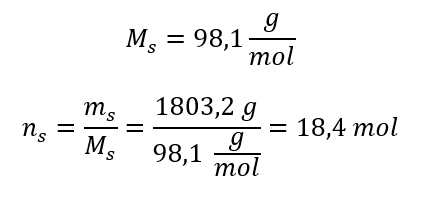 Stap 4. Berekening van de molaire concentratie wetende dat dit het aantal mol van de stof in 1 dm 3 van de oplossing is
Stap 4. Berekening van de molaire concentratie wetende dat dit het aantal mol van de stof in 1 dm 3 van de oplossing is 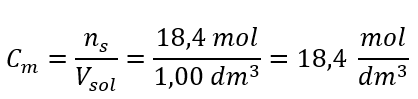 Methode 2. De relatie tussen procentuele concentratie en molaire concentratie gebruiken
Methode 2. De relatie tussen procentuele concentratie en molaire concentratie gebruiken 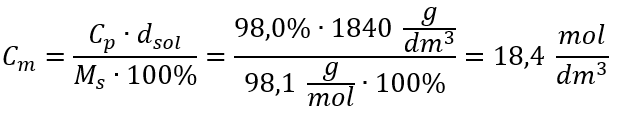 Antwoord: De molaire concentratie van dit zuur is 18,4 mol/dm 3 .
Antwoord: De molaire concentratie van dit zuur is 18,4 mol/dm 3 .

