เป็นหนึ่งในวิธีการใช้เครื่องมือที่เก่าแก่ที่สุดที่ใช้ในการวิเคราะห์ทางเคมี รากฐานของมันถูกวางโดย L. Galvani, CA Volta, JW Gibbs และ W. Nernst ระหว่าง ศตวรรษ ที่ 18 และ 19 การวัดด้วยวิธีโพเทนชิโอเมตริกใช้แรงเคลื่อนไฟฟ้า (EMF) ของเซลล์ที่สร้างจากอิเล็กโทรดสองตัวที่แช่อยู่ในสารละลายที่ทดสอบ ค่าของแรงนั้นขึ้นอยู่กับศักยภาพของอิเล็กโทรดที่ใช้โดยตรง สิ่งเหล่านี้จะขึ้นอยู่กับกิจกรรมของไอออนที่มีอยู่ในสารละลายอิเล็กโทรไลต์และธรรมชาติของกระบวนการอิเล็กโทรด
แผนภาพของกระบวนการอิเล็กโทรดที่แสดงตัวอย่างโดยเซลล์ Daniell
เซลล์แดเนียลล์ประกอบด้วยครึ่งเซลล์สองเซลล์ แต่ละเซลล์ประกอบด้วยโลหะที่แช่อยู่ในสารละลายเกลือของตัวมันเอง ส่วนประกอบครึ่งเซลล์เป็นระบบของ Cu (s) /Cu 2+ (aq) และ Zn (s) /Zn 2+ (aq) แต่ละคนผ่านหนึ่งในปฏิกิริยารีดอกซ์ต่อไปนี้:
- การลดน้อยลง
ลูกบาศ์ก 2+ (aq) + 2e – → ลูกบาศ์ก (s)
- ออกซิเดชัน
Zn (s) → Zn 2+ (aq) + 2e – เมื่อเรารวมปฏิกิริยาทั้งสองเข้าด้วยกัน เราจะได้สมการทั้งหมดสำหรับปฏิกิริยาที่เกิดขึ้นในเซลล์: Zn (s) + Cu 2+ (aq) + 2e – → Zn 2 + (aq) + 2e – + Cu (s) ในการวัดแรงเคลื่อนไฟฟ้าเฉพาะของเซลล์ เราต้องเชื่อมโยงครึ่งเซลล์โดยใช้ สะพานเกลือและต่อขั้วไฟฟ้าเข้ากับโวลต์มิเตอร์ . ดังนั้นเราจึงสามารถ วัดความแตกต่างของศักย์ระหว่างอิเล็กโทรดแต่ละตัว ซึ่งแสดงถึงค่า EMF ของเซลล์ ตามข้อตกลงของ IUPAC ไดอะแกรมของเซลล์ Daniell มีลักษณะดังนี้: ϴ Zn|Zn 2+ ||Cu 2+ |Cu ⊕ เส้นเดี่ยวหมายถึงอินเทอร์เฟซ และเส้นคู่แสดงถึงสะพานเกลือ ศักยภาพที่ส่วนต่อประสานเป็นผลมาจากปฏิกิริยาออกซิเดชันและปฏิกิริยารีดักชัน สำหรับเซลล์ เราถือว่า อิเล็กโทรดที่เกิดปฏิกิริยาออกซิเดชันคือแอโนดที่มีเครื่องหมาย ϴ ในขณะที่อีกขั้วหนึ่งเป็นขั้วบวกที่เกิดรีดักชัน สัญกรณ์เริ่มต้นด้วยขั้วบวกและแคโทดจะอยู่ทางด้านขวา แรงเคลื่อนไฟฟ้าของเซลล์ดังกล่าวสามารถคำนวณได้ตามสูตรต่อไปนี้: EMF = ศักย์ไฟฟ้าแคโทด – ศักย์แอโนด
ศักย์ไฟฟ้ามาตรฐาน
คำนี้ถูกนำมาใช้เพื่อการจัดระบบ และศักยภาพที่กำหนดของอิเล็กโทรดจะถือว่าเป็น "มาตรฐาน" หากเป็นไปตามเงื่อนไขบางประการ ควรทำการวัดที่ 298 K กิจกรรมของไอออนที่ใช้งานต้องเท่ากับ 1 โมล/dm 3 และอิเล็กโทรดอ้างอิงต้องเป็นอิเล็กโทรดไฮโดรเจนมาตรฐาน เนื่องจากสันนิษฐานว่าศักย์ไฟฟ้าของอิเล็กโทรดนั้นคือ 0.0000 V
แรงเคลื่อนไฟฟ้าของเซลล์
ค่า EMF เปลี่ยนแปลงพร้อมกับกิจกรรมที่เปลี่ยนแปลงของไอออนที่มีอยู่ในเซลล์ สมการที่สะท้อนความสัมพันธ์นี้เรียกว่า สมการ Nernst : 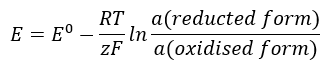 ใช้สัญลักษณ์ต่อไปนี้: ศักย์ไฟฟ้า (E), ศักย์ไฟฟ้ามาตรฐาน (E 0 ), ค่าคงที่ของก๊าซ (R) เท่ากับ 8.312 J/K·mol, อุณหภูมิ (T), จำนวนอิเล็กตรอนที่เกี่ยวข้องกับปฏิกิริยาเคมีไฟฟ้าของอิเล็กตรอน (z), ค่าคงที่ฟาราเดย์ (F) เท่ากับ 9.64853·10 4 C/mol และการทำงานของไอออนในรูปรีดิวซ์และออกซิไดซ์ สำหรับของแข็ง กิจกรรม (a) จะถือว่าเป็น 1
ใช้สัญลักษณ์ต่อไปนี้: ศักย์ไฟฟ้า (E), ศักย์ไฟฟ้ามาตรฐาน (E 0 ), ค่าคงที่ของก๊าซ (R) เท่ากับ 8.312 J/K·mol, อุณหภูมิ (T), จำนวนอิเล็กตรอนที่เกี่ยวข้องกับปฏิกิริยาเคมีไฟฟ้าของอิเล็กตรอน (z), ค่าคงที่ฟาราเดย์ (F) เท่ากับ 9.64853·10 4 C/mol และการทำงานของไอออนในรูปรีดิวซ์และออกซิไดซ์ สำหรับของแข็ง กิจกรรม (a) จะถือว่าเป็น 1 
เครื่องมือวัดโพเทนชิโอเมตริก
ชุดพื้นฐานสำหรับการวัดโพเทนชิโอเมตริกประกอบด้วยสององค์ประกอบ: อิเล็กโทรดคู่หนึ่งจุ่มอยู่ในสารละลายที่ทดสอบและอุปกรณ์วัด ส่วนประกอบแรกคือ เซลล์การวัด ในขณะที่ส่วนประกอบที่สองช่วยให้สามารถวัดแรงเคลื่อนไฟฟ้าได้อย่างแท้จริง ส่วนที่สำคัญที่สุดของเซลล์คืออิเล็กโทรด ตามกลไกการออกฤทธิ์สามารถจำแนกได้เป็นสี่กลุ่ม
สะพานเกลือ
องค์ประกอบที่สำคัญของเซลล์ใดๆ คือ สะพานเกลือ ซึ่งช่วยให้อิเล็กโทรดอ้างอิงติดต่อกับสารละลายที่ทดสอบได้ ลักษณะพื้นฐานของเซลล์ที่มีการถ่ายเทคือการสัมผัสระหว่างอิเล็กโทรไลต์ที่มีความเข้มข้นและองค์ประกอบต่างกัน เพื่อหลีกเลี่ยงการผสมอิเล็กโทรไลต์ของสะพานกับสารละลายที่ทดสอบ จะใช้พื้นผิวสัมผัสขนาดเล็ก
อิเล็กโทรดประเภทแรก
อิเล็กโทรดเหล่านี้ ทำจากโลหะหรือก๊าซที่แช่อยู่ในสารละลายที่มีไอออนของตัวเอง พวกมันเรียกอีกอย่างว่า อิเล็กโทรดที่ผันกลับ เป็นไอออน บวกได้ เช่นเดียวกับบนพื้นผิวของพวกมัน ปฏิกิริยาที่ผันกลับได้ต่อไปนี้เกิดขึ้น: M 0 ↔ M n+ + ne ตัวอย่างของอิเล็กโทรดประเภทแรกคืออิเล็กโทรดไฮโดรเจน
อิเล็กโทรดชนิดที่สอง
อิเล็กโทรดดังกล่าว สร้างขึ้นจากโลหะที่ปกคลุมด้วยเกลือที่ละลายได้น้อย ระบบนี้แช่อยู่ในเกลือที่ละลายได้อย่างอิสระ ซึ่งมีประจุลบแบบเดียวกับเกลือที่ละลายได้น้อย อิเล็กโทรดเหล่านี้เรียกว่า อิเล็กโทรดที่ผันกลับเป็นประจุลบได้ เนื่องจากบนพื้นผิวของอิออนจะเกิดปฏิกิริยาต่อไปนี้: M 0 + A – ↔ MA + e ตัวอย่างของอิเล็กโทรดประเภทที่สอง ได้แก่ อิเล็กโทรดซิลเวอร์คลอไรด์หรือคาโลเมล
อิเล็กโทรดชนิดที่สาม
สิ่งเหล่านี้ประกอบด้วยโลหะที่ล้อมรอบด้วยสองชั้น ชั้นแรกเป็นชั้นบางๆ ทำจากเกลือที่ละลายได้น้อยของโลหะนั้น และชั้นที่สองทำจากเกลือที่ละลายได้ดีกว่าเล็กน้อยซึ่งมีประจุลบเหมือนกัน พวกมันเป็น อิเล็กโทรดที่เปลี่ยนกลับเป็นไอออนบวกทั่วไปได้ เนื่องจากบนพื้นผิวของพวกมันจะเกิดปฏิกิริยาต่อไปนี้: M 0 (a) + M (b) A ↔ M (a) A + M + (b) + e 
รีดอกซ์อิเล็กโทรด
โครงสร้างของอิเล็กโทรดดังกล่าวมีลักษณะ พิเศษคือการใช้โลหะเฉื่อยทางเคมี เช่น แพลทินัมหรือทองคำ ซึ่งแช่อยู่ในสารละลายที่มีสารทั้งในรูปแบบรีดิวซ์และออกซิไดซ์ ตัวอย่างของอิเล็กโทรดดังกล่าวคืออิเล็กโทรดควินไฮโดรน
หน้าที่ของอิเล็กโทรดในระบบ
ในแง่ของการประยุกต์ใช้ในระบบวิเคราะห์ เราแยกแยะ:
- อิเล็กโทรดอ้างอิง ซึ่งรักษาศักย์ไฟฟ้าให้คงที่โดยไม่คำนึงถึงสภาวะการวัดหรือความเข้มข้นของสารละลายที่ทดสอบ
- อิเล็กโทรดตัวบ่ง ชี้ ซึ่งอาจเปลี่ยนแปลงได้หากสารละลายที่ทดสอบมีไอออนซึ่งไวต่ออิออน
อิเล็กโทรดอ้างอิง
การวัดโพเทนชิโอเมตริกขึ้นอยู่กับ การเปรียบเทียบศักย์ไฟฟ้าของอิเล็กโทรดตัวบ่งชี้กับอิเล็กโทรดอ้างอิง ด้วยเหตุนี้ อิเล็กโทรดดังกล่าวจึงต้องมีลักษณะดังนี้:
- ศักยภาพที่มั่นคง
- ศักยภาพในการทำซ้ำและความเป็นอิสระของอุณหภูมิ
- ความเก่งกาจและใช้งานง่าย
- ความต้านทานไฟฟ้าต่ำ,
- ความสามารถในการทำซ้ำและการแพร่กระจายต่ำ
- อิเล็กโทรไลต์ของอิเล็กโทรดไหลเพียงเล็กน้อยไปยังสารละลายที่ทดสอบ
อิเล็กโทรดอ้างอิงที่ใช้กันทั่วไปคืออิเล็กโทรดซิลเวอร์คลอไรด์ (Ag/AgCl/KCl) ซึ่งทำปฏิกิริยากับการมีอยู่ของคลอไรด์ไอออน มันถูกสร้างขึ้นจากลวดเงินที่เคลือบด้วยชั้นของซิลเวอร์คลอไรด์ อีกตัวอย่างหนึ่งคืออิเล็กโทรดคาโลเมล (Pt/Hg/Hg 2 Cl 2 /KCl) ซึ่งศักย์ไฟฟ้าขึ้นอยู่กับกิจกรรมในสารละลายคลอไรด์ไอออนด้วย
อิเล็กโทรดตัวบ่งชี้
สำหรับอิเล็กโทรดจากหมวดหมู่นี้ การเปลี่ยนแปลงที่อาจเกิดขึ้นเมื่อมีไอออนทดสอบอยู่ในสารละลาย ซึ่งหมายความว่า ศักยภาพของพวกมันขึ้นอยู่กับกิจกรรมโดยตรง เช่นเดียวกับความเข้มข้นของสารละลายที่ใส่เข้าไป ที่ใช้กันมากที่สุดคืออิเล็กโทรดที่แช่อยู่ในสารละลายของไอออนในตัวมันเอง เช่น อิเล็กโทรดเงิน ปรอท หรือไฮโดรเจน อย่างไรก็ตาม อิเล็กโทรดเยื่อเลือกไอออนถูกนำมาใช้ในโพเทนชิโอเมทรีสมัยใหม่ พวกมันมีลักษณะทั่วไปบางประการ เช่น ส่วนที่ใช้งานของพวกมันคือเมมเบรน และปฏิกิริยาไอออนิกระหว่างไอออนจากสารละลายและเมมเบรนจะเป็นตัวกำหนดความแตกต่างของศักย์ที่ส่วนต่อประสาน อิเล็กโทรดดังกล่าวสามารถแบ่งออกตามโครงสร้างเป็นแก้ว เมมเบรนแข็ง เมมเบรนของเหลว และอิเล็กโทรดเมมเบรนสองชั้น ที่ใช้บ่อยที่สุดคืออิเล็กโทรดแก้ว ซึ่งสร้างจากหลอดแก้วที่สิ้นสุดด้วยกระเปาะผนังบางที่ทำจากแก้วอิเล็กโทรด รองรับอิเล็กโทรดซิลเวอร์-ซิลเวอร์คลอไรด์ภายในที่แช่อยู่ในสารละลายภายในที่มีการทำงานของไอออนคงที่

