C'est l'une des plus anciennes méthodes instrumentales utilisées en analyse chimique. Ses fondations ont été posées par L. Galvani, CA Volta, JW Gibbs et W. Nernst entre les 18 e et 19 e siècles. Les mesures effectuées avec des méthodes potentiométriques utilisent la force électromotrice (EMF) d'une cellule composée de deux électrodes immergées dans la solution testée. La valeur de cette force dépend directement des potentiels des électrodes utilisées. Ceux-ci dépendent à leur tour de l'activité des ions contenus dans la solution d'électrolyte et de la nature des processus d'électrode.
Schéma des processus d’électrode illustrés par la cellule Daniell
La cellule Daniell est composée de deux demi-cellules, chacune composée d’un métal immergé dans la solution de son propre sel. Les demi-cellules composantes sont les systèmes Cu (s) /Cu 2+ (aq) et Zn (s) /Zn 2+ (aq) . Chacun d’eux subit l’une des réactions redox suivantes :
- réduction
Cu 2+ (aq) + 2e – → Cu (s)
- oxydation
Zn (s) → Zn 2+ (aq) + 2e – Lorsque nous combinons les deux réactions, nous obtenons l’équation complète de la réaction se produisant dans la cellule : Zn (s) + Cu 2+ (aq) + 2e – → Zn 2 + (aq) + 2e – + Cu (s) Pour mesurer une force électromotrice particulière de la cellule, il faut relier les demi-cellules par un pont de sel et connecter les électrodes à un voltmètre . Ainsi, nous pouvons mesurer la différence de potentiels entre les électrodes individuelles, qui représente la valeur EMF de la cellule . Selon la convention IUPAC, le diagramme de la cellule de Daniell se présente comme suit : ϴ Zn|Zn 2+ ||Cu 2+ |Cu ⊕ Les lignes simples représentent l’interface et les lignes doubles représentent le pont salin. Le potentiel à l’interface est le résultat des réactions d’oxydation et de réduction. Pour les cellules, nous supposons que l’électrode où se produit l’oxydation est l’anode avec le signe ϴ, tandis que l’autre est une cathode positive où se produit la réduction . La notation commence par l’anode et la cathode est notée sur le côté droit . La force électromotrice d’une telle cellule peut être calculée sur la base de la formule suivante : EMF = potentiel de cathode – potentiel d’anode
Potentiel d’électrode standard
Ce terme a été introduit pour systématisation, et un potentiel déterminé d’une électrode est considéré comme "standard" s’il satisfait à quelques conditions. La mesure doit être effectuée à 298 K, l’activité des ions actifs doit être égale à 1 mol/dm 3 et l’électrode de référence doit être une électrode à hydrogène standard, car on suppose que le potentiel de cette électrode est de 0,0000 V.
Force électromotrice de la cellule
La valeur EMF change avec l’activité changeante des ions présents dans la cellule. L’équation qui reflète cette relation s’appelle l’ équation de Nernst : 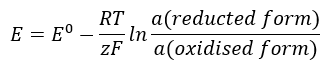 Il utilise les symboles suivants : potentiel d’électrode (E), potentiel d’électrode standard (E 0 ), constante des gaz (R) égale à 8,312 J/K·mol, température (T), le nombre d’électrons impliqués dans la réaction électrochimique des électrons (z), constante de Faraday (F) égale à 9,64853.10 4 C/mol, et l’activité des ions sous les formes réduites et oxydées. Pour les solides, l’activité (a) est supposée égale à 1.
Il utilise les symboles suivants : potentiel d’électrode (E), potentiel d’électrode standard (E 0 ), constante des gaz (R) égale à 8,312 J/K·mol, température (T), le nombre d’électrons impliqués dans la réaction électrochimique des électrons (z), constante de Faraday (F) égale à 9,64853.10 4 C/mol, et l’activité des ions sous les formes réduites et oxydées. Pour les solides, l’activité (a) est supposée égale à 1. 
Instrumentation potentiométrique
L’ensemble de base pour les mesures potentiométriques se compose de deux composants : une paire d’électrodes immergées dans la solution testée et un appareil de mesure . Le premier composant est la cellule de mesure , tandis que le second permet la mesure proprement dite de sa force électromotrice. La partie la plus importante d’une cellule sont les électrodes. Selon leur mécanisme d’action, ils peuvent être classés en quatre groupes.
Pont de sel
Un élément important de toute cellule est le pont salin, qui permet à l’électrode de référence d’entrer en contact avec la solution testée . La caractéristique fondamentale d’une cellule avec transfert est le contact entre des électrolytes de différentes concentrations et compositions. Pour éviter le mélange de l’électrolyte du pont avec la solution testée, de petites surfaces de contact sont utilisées.
Électrodes du premier type
Ces électrodes sont constituées d’un métal ou d’un gaz immergé dans la solution contenant leurs propres ions . On les appelle aussi électrodes réversibles au cation , car à leur surface se produit la réaction réversible suivante : M 0 ↔ M n+ + ne Un exemple d’électrodes du premier type est l’électrode à hydrogène.
Électrodes du deuxième type
De telles électrodes sont constituées d’un métal recouvert de son sel peu soluble . Le système est immergé dans un sel librement soluble, qui contient le même anion que le sel peu soluble. Ces électrodes sont appelées électrodes réversibles à l’anion commun , car à leur surface se produit la réaction suivante : M 0 + A – ↔ MA + e Des exemples d’électrodes du second type comprennent les électrodes argent-chlorure d’argent ou calomel.
Électrodes du troisième type
Ceux-ci sont composés de métaux entourés de deux couches : la première couche mince constituée d’un sel peu soluble de ce métal et la seconde couche constituée d’un sel légèrement mieux soluble qui contient le même anion. Ce sont des électrodes réversibles au cation commun , car à leur surface se produit la réaction suivante : M 0 (a) + M (b) A ↔ M (a) A + M + (b) + e 
Électrodes redox
La structure de telles électrodes est caractérisée par l’utilisation d’un métal chimiquement inerte, par exemple du platine ou de l’or, qui est immergé dans une solution contenant une substance à la fois sous forme réduite et oxydée . Un exemple de telles électrodes est l’électrode quinhydrone.
Fonctions des électrodes dans un système
En termes d’application dans un système analytique, on distingue :
- des électrodes de référence , qui maintiennent un potentiel constant quelles que soient les conditions de mesure ou la concentration de la solution testée.
- des électrodes indicatrices , dont le potentiel change si la solution testée contient des ions, auxquels elles sont sensibles.
Électrodes de référence
La mesure potentiométrique est basée sur la comparaison du potentiel de l’électrode indicatrice avec l’électrode de référence . Pour cette raison, de telles électrodes doivent être caractérisées par :
- potentiel stable,
- indépendance reproductible du potentiel et de la température,
- polyvalence et facilité d’utilisation,
- faible résistance électrique,
- reproductible et faible potentiel de diffusion,
- peu d’écoulement de l’électrolyte de l’électrode vers la solution testée.
Une électrode de référence couramment utilisée est l’électrode argent-chlorure d’argent (Ag/AgCl/KCl), qui réagit à la présence d’ions chlorure. Il est constitué d’un fil d’argent recouvert d’une couche de chlorure d’argent. Un autre exemple est l’électrode au calomel (Pt/Hg/Hg 2 Cl 2 /KCl), dont le potentiel dépend également de l’activité dans une solution d’ions chlorure.
Électrodes indicatrices
Pour les électrodes de cette catégorie , leur potentiel change en présence d’ions testés dans la solution . Cela signifie que leur potentiel dépend directement de l’activité, donc aussi de la concentration, de la solution dans laquelle ils sont placés . Les plus couramment utilisées sont les électrodes immergées dans les solutions de leurs propres ions, telles que les électrodes d’argent, de mercure ou d’hydrogène. Cependant, les électrodes à membrane sélectives d’ions sont utilisées dans la potentiométrie moderne. Ils ont des caractéristiques communes, par exemple, leur partie active est la membrane, et la réaction ionique entre les ions de la solution et la membrane détermine la différence de potentiel à leur interface. Ces électrodes peuvent être divisées en fonction de leur structure en électrodes de verre, à membrane solide, à membrane liquide et à double membrane. Les plus utilisées sont les électrodes de verre, constituées d’un tube de verre terminé par une ampoule à paroi mince en verre d’électrode. Il accueille l’électrode interne en argent-chlorure d’argent immergée dans la solution interne avec une activité constante des ions.

