Ia adalah salah satu kaedah instrumental tertua yang digunakan dalam analisis kimia. Asasnya telah diletakkan oleh L. Galvani, CA Volta, JW Gibbs, dan W. Nernst antara abad ke- 18 dan ke -19. Pengukuran yang dilakukan dengan kaedah potensiometri menggunakan daya gerak elektrik (EMF) sel yang dibina daripada dua elektrod yang direndam dalam larutan yang diuji. Nilai daya itu secara langsung bergantung kepada potensi elektrod yang digunakan. Ini pula bergantung kepada aktiviti ion yang terkandung dalam larutan elektrolit dan pada sifat proses elektrod.
Gambar rajah proses elektrod yang ditunjukkan oleh sel Daniell
Sel Daniell diperbuat daripada dua separuh sel, setiap satu terdiri daripada logam yang direndam dalam larutan garamnya sendiri. Separuh sel komponen ialah sistem Cu (s) /Cu 2+ (aq) dan Zn (s) /Zn 2+ (aq) . Setiap daripada mereka mengalami salah satu daripada tindak balas redoks berikut:
- pengurangan
Cu 2+ (aq) + 2e – → Cu (s)
- pengoksidaan
Zn (s) → Zn 2+ (aq) + 2e – Apabila kita menggabungkan kedua-dua tindak balas, kita memperoleh persamaan penuh untuk tindak balas yang berlaku dalam sel: Zn (s) + Cu 2+ (aq) + 2e – → Zn 2 + (aq) + 2e – + Cu (s) Untuk mengukur daya gerak elektrik tertentu sel, kita perlu memautkan separuh sel menggunakan jambatan garam dan menyambungkan elektrod kepada voltmeter . Oleh itu, kita boleh mengukur perbezaan potensi antara elektrod individu, yang mewakili nilai EMF sel . Menurut konvensyen IUPAC, rajah sel Daniell kelihatan seperti berikut: ϴ Zn|Zn 2+ ||Cu 2+ |Cu ⊕ Garis tunggal melambangkan antara muka, dan garisan berkembar mewakili jambatan garam. Potensi pada antara muka adalah hasil daripada tindak balas pengoksidaan dan pengurangan. Untuk sel, kami mengandaikan bahawa elektrod di mana pengoksidaan berlaku ialah anod dengan tanda ϴ, manakala yang satu lagi ialah katod positif di mana pengurangan berlaku . Notasi bermula dengan anod, dan katod dicatat di sebelah kanan . Daya gerak elektrik sel sedemikian boleh dikira berdasarkan formula berikut: EMF = potensi katod – potensi anod
Potensi elektrod piawai
Istilah ini telah diperkenalkan untuk sistematisasi, dan potensi yang ditentukan bagi elektrod dianggap "standard" jika ia memenuhi beberapa syarat. Pengukuran hendaklah dilakukan pada 298 K, aktiviti ion aktif mestilah sama dengan 1 mol/dm 3 , dan elektrod rujukan mestilah elektrod hidrogen standard, kerana diandaikan bahawa potensi elektrod itu ialah 0.0000 V.
Daya elektromotif sel
Nilai EMF berubah bersama-sama dengan perubahan aktiviti ion yang terdapat dalam sel. Persamaan yang mencerminkan hubungan ini dipanggil persamaan Nernst : 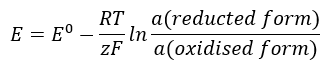 Ia menggunakan simbol berikut: keupayaan elektrod (E), potensi elektrod piawai (E 0 ), pemalar gas (R) bersamaan dengan 8.312 J/K·mol, suhu (T), bilangan elektron yang terlibat dalam tindak balas elektrokimia elektron (z), pemalar Faraday (F) bersamaan dengan 9.64853·10 4 C/mol, dan aktiviti ion dalam bentuk terkurang dan teroksida. Bagi pepejal, aktiviti (a) diandaikan sebagai 1.
Ia menggunakan simbol berikut: keupayaan elektrod (E), potensi elektrod piawai (E 0 ), pemalar gas (R) bersamaan dengan 8.312 J/K·mol, suhu (T), bilangan elektron yang terlibat dalam tindak balas elektrokimia elektron (z), pemalar Faraday (F) bersamaan dengan 9.64853·10 4 C/mol, dan aktiviti ion dalam bentuk terkurang dan teroksida. Bagi pepejal, aktiviti (a) diandaikan sebagai 1. 
Instrumentasi potensiometri
Set asas untuk pengukuran potensiometri terdiri daripada dua komponen: sepasang elektrod yang direndam dalam larutan yang diuji dan alat pengukur . Komponen pertama ialah sel pengukur , manakala yang kedua membolehkan pengukuran sebenar daya gerak elektriknya. Bahagian yang paling penting dalam sel ialah elektrod. Mengikut mekanisme tindakan mereka, mereka boleh dikelaskan kepada empat kumpulan.
Jambatan garam
Unsur penting mana-mana sel ialah jambatan garam, yang membolehkan elektrod rujukan menghubungi penyelesaian yang diuji . Ciri asas sel dengan pemindahan ialah sentuhan antara elektrolit dengan kepekatan dan komposisi yang berbeza. Untuk mengelakkan pencampuran elektrolit jambatan dengan larutan yang diuji, permukaan sentuhan kecil digunakan.
Elektrod jenis pertama
Elektrod ini diperbuat daripada logam atau gas yang direndam dalam larutan yang mengandungi ionnya sendiri . Ia juga dipanggil elektrod boleh balik kepada kation , seperti pada permukaannya, tindak balas boleh balik berikut berlaku: M 0 ↔ M n+ + ne Contoh elektrod jenis pertama ialah elektrod hidrogen.
Elektrod jenis kedua
Elektrod sedemikian dibina daripada logam yang ditutup dengan garamnya yang jarang larut . Sistem ini direndam dalam garam larut bebas, yang mengandungi anion yang sama dengan garam yang jarang larut. Elektrod ini dipanggil elektrod boleh diterbalikkan kepada anion sepunya , kerana pada permukaannya tindak balas berikut berlaku: M 0 + A – ↔ MA + e Contoh elektrod jenis kedua termasuk perak-perak klorida atau elektrod calomel.
Elektrod jenis ketiga
Ini terdiri daripada logam yang dikelilingi oleh dua lapisan: lapisan pertama, nipis yang diperbuat daripada garam yang agak mudah larut daripada logam itu, dan lapisan kedua diperbuat daripada garam larut yang lebih baik sedikit yang mengandungi anion yang sama. Ia adalah elektrod yang boleh diterbalikkan kepada kation biasa , kerana pada permukaannya tindak balas berikut berlaku: M 0 (a) + M (b) A ↔ M (a) A + M + (b) + e 
Elektrod redoks
Struktur elektrod tersebut dicirikan oleh penggunaan logam lengai secara kimia, contohnya platinum atau emas, yang direndam dalam larutan yang mengandungi bahan dalam kedua-dua bentuk terkurang dan teroksida . Contoh elektrod tersebut ialah elektrod quinhydrone.
Fungsi elektrod dalam sistem
Dari segi aplikasi dalam sistem analisis, kami membezakan:
- elektrod rujukan , yang mengekalkan potensi malar tanpa mengira keadaan mengukur atau kepekatan larutan yang diuji.
- elektrod penunjuk , yang potensinya berubah jika larutan yang diuji mengandungi ion, yang mana ia sensitif.
Elektrod rujukan
Pengukuran potensiometri adalah berdasarkan perbandingan potensi elektrod penunjuk dengan elektrod rujukan . Atas sebab ini, elektrod tersebut mesti dicirikan oleh:
- potensi yang stabil,
- potensi boleh dihasilkan semula dan kebebasan suhu,
- serba boleh dan kemudahan penggunaan,
- rintangan elektrik yang rendah,
- boleh dihasilkan semula dan potensi resapan rendah,
- sedikit aliran elektrolit elektrod ke larutan yang diuji.
Elektrod rujukan yang biasa digunakan ialah elektrod perak-perak klorida (Ag/AgCl/KCl), yang bertindak balas terhadap kehadiran ion klorida. Ia dibina daripada dawai perak yang disalut dengan lapisan perak klorida. Contoh lain ialah elektrod calomel (Pt/Hg/Hg 2 Cl 2 /KCl), yang potensinya juga bergantung kepada aktiviti dalam larutan ion klorida.
Elektrod penunjuk
Bagi elektrod dari kategori ini potensinya berubah dengan kehadiran ion yang diuji dalam larutan . Ini bermakna bahawa potensi mereka secara langsung bergantung kepada aktiviti, begitu juga kepekatan, larutan di mana ia diletakkan . Yang paling biasa digunakan ialah elektrod yang direndam dalam larutan ionnya sendiri, seperti elektrod perak, merkuri atau hidrogen. Walau bagaimanapun, elektrod membran selektif ion digunakan dalam potensiometri moden. Mereka mempunyai beberapa ciri umum, sebagai contoh, bahagian aktifnya ialah membran, dan tindak balas ionik antara ion daripada larutan dan membran menentukan perbezaan potensi pada antara muka mereka. Elektrod tersebut boleh dibahagikan berdasarkan strukturnya kepada kaca, membran pepejal, membran cecair, dan elektrod membran berganda. Yang paling kerap digunakan ialah elektrod kaca, yang dibina daripada tiub kaca yang ditamatkan dengan mentol berdinding nipis yang diperbuat daripada kaca elektrod. Ia menampung elektrod klorida perak-perak dalaman yang direndam dalam larutan dalaman dengan aktiviti ion yang berterusan.

