Je to jedna z nejstarších instrumentálních metod používaných v chemické analýze. Jeho základy položili L. Galvani, CA Volta, JW Gibbs a W. Nernst mezi 18. a 19. stoletím . Měření prováděná potenciometrickými metodami využívají elektromotorickou sílu (EMF) článku sestaveného ze dvou elektrod ponořených do testovaného roztoku. Hodnota této síly přímo závisí na potenciálech použitých elektrod. Ty zase závisí na aktivitě iontů obsažených v roztoku elektrolytu a na povaze elektrodových procesů.
Schéma elektrodových procesů na příkladu Daniellova článku
Daniellův článek se skládá ze dvou poločlánků, z nichž každý je složen z kovu ponořeného do roztoku vlastní soli. Složkovými poločlánky jsou systémy Cu (s) /Cu2 + (aq) a Zn (s) /Zn2 + (aq) . Každý z nich prochází jednou z následujících redoxních reakcí:
- redukce
Cu 2+ (aq) + 2e – → Cu (s)
- oxidace
Zn (s) → Zn 2+ (aq) + 2e – Když spojíme obě reakce, dostaneme úplnou rovnici pro reakci probíhající v buňce: Zn (s) + Cu 2+ (aq) + 2e – → Zn 2 + (aq) + 2e – + Cu (s) Abychom mohli změřit konkrétní elektromotorickou sílu článku, musíme poločlánky propojit solným můstkem a připojit elektrody k voltmetru . Můžeme tak změřit rozdíl potenciálů mezi jednotlivými elektrodami, který představuje hodnotu EMF článku . Podle konvence IUPAC vypadá diagram Daniellovy buňky následovně: ϴ Zn|Zn 2+ ||Cu 2+ |Cu ⊕ Jednoduché čáry představují rozhraní a dvojité čáry představují solný můstek. Potenciál na rozhraní je výsledkem oxidačních a redukčních reakcí. U článků předpokládáme, že elektroda, kde dochází k oxidaci, je anoda se znaménkem ϴ, zatímco druhá je kladná katoda, kde dochází k redukci . Zápis začíná anodou a katoda je uvedena na pravé straně . Elektromotorickou sílu takového článku lze vypočítat na základě následujícího vzorce: EMF = katodový potenciál – anodový potenciál
Standardní elektrodový potenciál
Tento termín byl zaveden pro systematizaci a stanovený potenciál elektrody je považován za „standardní“, pokud splňuje několik podmínek. Měření by mělo být prováděno při 298 K, aktivita aktivních iontů musí být rovna 1 mol/dm 3 a referenční elektrodou musí být standardní vodíková elektroda, protože se předpokládá, že potenciál této elektrody je 0,0000 V.
Elektromotorická síla článku
Hodnota EMF se mění spolu s měnící se aktivitou iontů přítomných v buňce. Rovnice, která odráží tento vztah, se nazývá Nernstova rovnice : 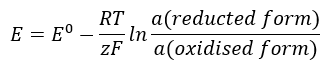 Používá tyto symboly: elektrodový potenciál (E), standardní elektrodový potenciál (E 0 ), plynová konstanta (R) rovna 8,312 J/K·mol, teplota (T), počet elektronů zapojených do elektrochemické reakce elektronů (z), Faradayova konstanta (F) rovna 9,64853·10 4 C/mol a aktivita iontů v redukované a oxidované formě. U pevných látek se předpokládá, že aktivita (a) je 1.
Používá tyto symboly: elektrodový potenciál (E), standardní elektrodový potenciál (E 0 ), plynová konstanta (R) rovna 8,312 J/K·mol, teplota (T), počet elektronů zapojených do elektrochemické reakce elektronů (z), Faradayova konstanta (F) rovna 9,64853·10 4 C/mol a aktivita iontů v redukované a oxidované formě. U pevných látek se předpokládá, že aktivita (a) je 1. 
Potenciometrická instrumentace
Základní sada pro potenciometrická měření se skládá ze dvou součástí: dvojice elektrod ponořených do testovaného roztoku a měřicího zařízení . První komponentou je měřicí článek , druhý umožňuje vlastní měření jeho elektromotorické síly. Nejdůležitější částí článku jsou elektrody. Podle mechanismu účinku je lze rozdělit do čtyř skupin.
Solný most
Důležitým prvkem každého článku je solný můstek, který umožňuje referenční elektrodě kontakt s testovaným roztokem . Základní charakteristikou článku s přenosem je kontakt mezi elektrolyty různých koncentrací a složení. Aby se zabránilo smíchání elektrolytu můstku s testovaným roztokem, používají se malé kontaktní plochy.
Elektrody prvního druhu
Tyto elektrody jsou vyrobeny z kovu nebo plynu ponořeného do roztoku obsahujícího jejich vlastní ionty . Říká se jim také elektrody vratné ke kationtu , protože na jejich povrchu dochází k následující vratné reakci: M 0 ↔ M n+ + ne Příkladem elektrod prvního druhu je vodíková elektroda.
Elektrody druhého druhu
Takové elektrody jsou vyrobeny z kovu pokrytého jeho těžko rozpustnou solí . Systém je ponořen do volně rozpustné soli, která obsahuje stejný aniont jako málo rozpustná sůl. Tyto elektrody se nazývají elektrody reverzibilní na společný anion , protože na jejich povrchu probíhá následující reakce: M 0 + A – ↔ MA + e Příklady elektrod druhého druhu zahrnují elektrody stříbro-chlorid stříbrný nebo kalomelové.
Elektrody třetího druhu
Ty se skládají z kovů obklopených dvěma vrstvami: první, tenká vrstva vyrobená z těžko rozpustné soli tohoto kovu, a druhá vrstva vyrobená z mírně lépe rozpustné soli, která obsahuje stejný anion. Jsou to elektrody reverzibilní na společný kationt , protože na jejich povrchu probíhá následující reakce: M 0 (a) + M (b) A ↔ M (a) A + M + (b) + e 
Redoxní elektrody
Struktura takových elektrod je charakterizována použitím chemicky inertního kovu, například platiny nebo zlata, který je ponořen do roztoku obsahujícího látku v redukované i oxidované formě . Příkladem takových elektrod je chinhydronová elektroda.
Funkce elektrod v systému
Z hlediska aplikace v analytickém systému rozlišujeme:
- referenční elektrody , které udržují konstantní potenciál bez ohledu na podmínky měření nebo koncentraci testovaného roztoku.
- indikátorové elektrody , jejichž potenciál se mění, pokud testovaný roztok obsahuje ionty, na které jsou citlivé.
Referenční elektrody
Potenciometrické měření je založeno na porovnání potenciálu indikační elektrody s referenční elektrodou . Z tohoto důvodu musí být takové elektrody charakterizovány:
- stabilní potenciál,
- reprodukovatelný potenciál a teplotní nezávislost,
- všestrannost a snadné použití,
- nízký elektrický odpor,
- reprodukovatelný a nízký difúzní potenciál,
- malý průtok elektrolytu elektrody do testovaného roztoku.
Běžně používanou referenční elektrodou je elektroda stříbro-chlorid stříbrný (Ag/AgCl/KCl), která reaguje na přítomnost chloridových iontů. Je postaven ze stříbrného drátu potaženého vrstvou chloridu stříbrného. Dalším příkladem je kalomelová elektroda (Pt/Hg/Hg 2 Cl 2 /KCl), jejíž potenciál také závisí na aktivitě v roztoku chloridových iontů.
Indikační elektrody
U elektrod této kategorie se jejich potenciál mění v přítomnosti testovaných iontů v roztoku . To znamená, že jejich potenciál přímo závisí na aktivitě, tedy i koncentraci, roztoku, ve kterém jsou umístěny . Nejčastěji se používají elektrody ponořené do roztoků vlastních iontů, jako jsou stříbrné, rtuťové nebo vodíkové elektrody. V moderní potenciometrii se však používají iontově selektivní membránové elektrody. Mají některé společné vlastnosti, například jejich aktivní částí je membrána a iontová reakce mezi ionty z roztoku a membrány určuje rozdíl potenciálu na jejich rozhraní. Takové elektrody lze rozdělit na základě jejich struktury na elektrody skleněné, pevné membrány, kapalinové membrány a elektrody s dvojitou membránou. Nejčastěji se používají skleněné elektrody, které jsou vyrobeny ze skleněné trubice zakončené tenkostěnnou baňkou z elektrodového skla. Pojme vnitřní elektrodu stříbro-chlorid stříbrnou ponořenou do vnitřního roztoku s konstantní aktivitou iontů.

