É um dos métodos instrumentais mais antigos usados em análises químicas. Suas fundações foram lançadas por L. Galvani, CA Volta, JW Gibbs e W. Nernst entre os séculos XVIII e XIX . As medições realizadas com métodos potenciométricos utilizam a força eletromotriz (EMF) de uma célula constituída por dois eletrodos imersos na solução testada. O valor dessa força depende diretamente dos potenciais dos eletrodos utilizados. Estes, por sua vez, dependem da atividade dos íons contidos na solução eletrolítica e da natureza dos processos do eletrodo.
Diagrama de processos de eletrodos exemplificados pela célula de Daniell
A célula de Daniell é feita de duas meias células, cada uma composta de um metal imerso na solução de seu próprio sal. As semicélulas componentes são os sistemas de Cu (s) /Cu 2+ (aq) e Zn (s) /Zn 2+ (aq) . Cada um deles sofre uma das seguintes reações redox:
- redução
Cu 2+ (aq) + 2e – → Cu (s)
- oxidação
Zn (s) → Zn 2+ (aq) + 2e – Quando combinamos as duas reações, obtemos a equação completa para a reação que ocorre na célula: Zn (s) + Cu 2+ (aq) + 2e – → Zn 2 + (aq) + 2e – + Cu (s) Para medir uma determinada força eletromotriz da célula, temos que ligar as meias-células usando uma ponte salina e conectar os eletrodos a um voltímetro . Assim, podemos medir a diferença de potencial entre os eletrodos individuais, o que representa o valor EMF da célula . De acordo com a convenção IUPAC, o diagrama da célula de Daniell é o seguinte: ϴ Zn|Zn 2+ ||Cu 2+ |Cu ⊕ As linhas simples representam a interface e as linhas duplas representam a ponte salina. O potencial na interface é resultado das reações de oxidação e redução. Para as células, assumimos que o eletrodo onde ocorre a oxidação é o ânodo com o sinal ϴ, enquanto o outro é um cátodo positivo onde ocorre a redução . A notação começa com o ânodo e o cátodo é anotado no lado direito . A força eletromotriz de tal célula pode ser calculada com base na seguinte fórmula: EMF = potencial do cátodo – potencial do ânodo
Potencial de eletrodo padrão
Este termo foi introduzido para sistematização, e um determinado potencial de um eletrodo é considerado “padrão” se satisfizer algumas condições. A medição deve ser realizada a 298 K, a atividade dos íons ativos deve ser igual a 1 mol/dm 3 , e o eletrodo de referência deve ser um eletrodo padrão de hidrogênio, pois assume-se que o potencial desse eletrodo é de 0,0000 V.
Força eletromotriz da célula
O valor EMF muda junto com a atividade variável dos íons presentes na célula. A equação que reflete essa relação é chamada de equação de Nernst : 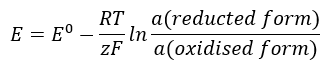 Ele usa os seguintes símbolos: potencial de eletrodo (E), potencial de eletrodo padrão (E 0 ), constante de gás (R) igual a 8,312 J/K·mol, temperatura (T), o número de elétrons envolvidos na reação eletroquímica de elétrons (z), constante de Faraday (F) igual a 9,64853·10 4 C/mol, e a atividade dos íons nas formas reduzida e oxidada. Para sólidos, a atividade (a) é assumida como 1.
Ele usa os seguintes símbolos: potencial de eletrodo (E), potencial de eletrodo padrão (E 0 ), constante de gás (R) igual a 8,312 J/K·mol, temperatura (T), o número de elétrons envolvidos na reação eletroquímica de elétrons (z), constante de Faraday (F) igual a 9,64853·10 4 C/mol, e a atividade dos íons nas formas reduzida e oxidada. Para sólidos, a atividade (a) é assumida como 1. 
Instrumentação potenciométrica
O conjunto básico para medições potenciométricas consiste em dois componentes: um par de eletrodos imersos na solução testada e um dispositivo de medição . O primeiro componente é a célula de medição , enquanto o segundo permite a medição real de sua força eletromotriz. A parte mais importante de uma célula são os eletrodos. De acordo com seu mecanismo de ação, podem ser classificados em quatro grupos.
Ponte de sal
Um elemento importante de qualquer célula é a ponte salina, que permite que o eletrodo de referência entre em contato com a solução testada . A característica fundamental de uma célula com transferência é o contato entre eletrólitos de diferentes concentrações e composições. Para evitar a mistura do eletrólito da ponte com a solução testada, pequenas superfícies de contato são usadas.
Eletrodos do primeiro tipo
Esses eletrodos são feitos de um metal ou gás imerso na solução contendo seus próprios íons . Eles também são chamados de eletrodos reversíveis ao cátion , pois em sua superfície ocorre a seguinte reação reversível: M 0 ↔ M n+ + ne Um exemplo de eletrodos do primeiro tipo é o eletrodo de hidrogênio.
Eletrodos do segundo tipo
Esses eletrodos são feitos de um metal coberto com seu sal pouco solúvel . O sistema é imerso em um sal livremente solúvel, que contém o mesmo ânion que o sal pouco solúvel. Esses eletrodos são chamados de eletrodos reversíveis ao ânion comum , pois em sua superfície ocorre a seguinte reação: M 0 + A – ↔ MA + e Exemplos de eletrodos do segundo tipo incluem os eletrodos de prata-cloreto de prata ou calomelano.
Eletrodos de terceiro tipo
Estes são compostos de metais rodeados por duas camadas: a primeira, fina camada feita de um sal pouco solúvel desse metal, e a segunda camada feita de um sal ligeiramente melhor solúvel que contém o mesmo ânion. São eletrodos reversíveis ao cátion comum , pois em sua superfície ocorre a seguinte reação: M 0 (a) + M (b) A ↔ M (a) A + M + (b) + e 
Eletrodos Redox
A estrutura destes eléctrodos é caracterizada pela utilização de um metal quimicamente inerte, por exemplo platina ou ouro, que é imerso numa solução que contém uma substância tanto na forma reduzida como na forma oxidada. Um exemplo de tais eletrodos é o eletrodo de quinidrona.
Funções dos eletrodos em um sistema
Em termos de aplicação num sistema analítico, distinguimos:
- eletrodos de referência , que mantêm um potencial constante independentemente das condições de medição ou da concentração da solução testada.
- eletrodos indicadores , cujo potencial muda se a solução testada contiver íons, aos quais eles são sensíveis.
Eletrodos de referência
A medição potenciométrica é baseada na comparação do potencial do eletrodo indicador com o eletrodo de referência . Por esta razão, tais eletrodos devem ser caracterizados por:
- potencial estável,
- potencial reprodutível e independência de temperatura,
- versatilidade e facilidade de uso,
- baixa resistência elétrica,
- reprodutível e baixo potencial de difusão,
- pouco fluxo do eletrólito do eletrodo para a solução testada.
Um eletrodo de referência comumente usado é o eletrodo de prata-cloreto de prata (Ag/AgCl/KCl), que reage à presença de íons cloreto. É construído com um fio de prata revestido com uma camada de cloreto de prata. Outro exemplo é o eletrodo de calomelano (Pt/Hg/Hg 2 Cl 2 /KCl), cujo potencial também depende da atividade em uma solução de íons cloreto.
Eletrodos indicadores
Para os eletrodos desta categoria seu potencial muda na presença dos íons testados na solução . Isso significa que seu potencial depende diretamente da atividade e também da concentração da solução em que são colocados . Os mais comumente usados são eletrodos imersos em soluções de seus próprios íons, como eletrodos de prata, mercúrio ou hidrogênio. No entanto, eletrodos de membrana seletiva de íons são usados na potenciometria moderna. Eles têm algumas características comuns, por exemplo, sua parte ativa é a membrana, e a reação iônica entre os íons da solução e a membrana determina a diferença de potencial em sua interface. Esses eletrodos podem ser divididos com base em sua estrutura em eletrodos de vidro, membrana sólida, membrana líquida e membrana dupla. Os mais usados são os eletrodos de vidro, que são construídos com um tubo de vidro terminado em um bulbo de paredes finas feito de vidro de eletrodo. Ele acomoda o eletrodo interno de prata-cloreto de prata imerso na solução interna com uma atividade constante de íons.

