Es ist eine der ältesten instrumentellen Methoden, die in der chemischen Analyse verwendet werden. Die Grundlagen für diese Methode wurden von L. Galvani, C.A. Volta, J.W. Gibbs und W. Nernst zwischen dem 18. und 19. Jahrhundert gelegt. Potentiometrische Methoden nutzen die elektromotorische Kraft (EMK) einer Zelle, die aus zwei Elektroden besteht, die während der Messungen in die zu untersuchende Lösung getaucht werden. Der Wert dieser Kraft hängt direkt von den Potenzialen der verwendeten Elektroden ab. Diese wiederum hängen von der Aktivität der Ionen in der Elektrolytlösung und von der Art der Elektrodenprozesse ab.
Schema der Elektrodenprozesse am Beispiel des Daniell-Elements
Das Daniell-Element besteht aus zwei Halbzellen, die jeweils aus einem Metall bestehen, das in eine Lösung seines Salzes eingetaucht ist. Die bildenden Halbzellen sind die Systeme Cu(s)/Cu2+(aq) und Zn(s)/Zn2+(aq). An jedem dieser Systeme findet eine der Redoxreaktionen statt:
- Reduktionsprozess
Cu2+(aq) + 2e– → Cu(s)
- Oxidationsprozess
Zn(s) →Zn2+(aq) + 2e–
Verbindet man die beiden Reaktionen, erhält man die vollständige Gleichung der in der Zelle ablaufenden Reaktion:
Zn(s) + Cu2+(aq) + 2e– →Zn2+(aq) + 2e– + Cu(s)
Um die elektromotorische Kraft der Zelle, die uns interessiert, zu messen, müssen wir die Halbzellen mit einem Elektrolytschlüssel verbinden und die Elektroden an ein Voltmeter anschließen. Auf diese Weise lässt sich die Potenzialdifferenz der einzelnen Elektroden messen, die den EMK-Wert der Zelle darstellt. Gemäß der Konvention IUPAC sieht das Diagramm eines Daniell-Elements wie folgt aus:
ϴZn|Zn2+||Cu2+|Cu⊕
Die einzelnen Linien symbolisieren die Phasengrenze und die Doppellinien den elektrolytischen Schlüssel. Das an der Phasengrenze auftretende Potenzial ist das Ergebnis der stattfindenden Oxidations- und Reduktionsreaktionen. In den Zellen wird angenommen, dass die Elektrode, an der die Oxidation stattfindet, die Anode mit dem Vorzeichen ϴ ist und die andere Elektrode die positive Kathode ist, an der die Reduktionsreaktion stattfindet. Im Diagramm beginnt die Notation mit der Anode, während die Kathode auf der rechten Seite geschrieben ist. Die elektromotorische Kraft einer solchen Zelle kann anhand der folgenden Formel berechnet werden:
EMK = Kathodenpotential – Anodenpotential
Standardpotential der Elektroden
Um dieses richtig zu systematisieren, wurde dieser Begriff eingeführt, und das ermittelte Elektrodenpotential muss, um ein Standardpotential zu sein, mehrere Bedingungen erfüllen. Die Messung muss bei 298 K durchgeführt werden, die Aktivität der aktiven Ionen muss gleich 1 mol/dm3 sein und es ist notwendig, eine Standard-Wasserstoffelektrode als Referenzelektrode zu verwenden. Es wird nämlich angenommen, dass das Potenzial dieser Elektrode 0,0000 V beträgt.
Die elektromotorische Kraft der Zelle
Der Wert des EMK ändert sich mit der sich ändernden Aktivität der in der Zelle vorhandenen Ionen. Die Gleichung, die diese Abhängigkeit widerspiegelt, wird Nernst-Gleichung genannt:
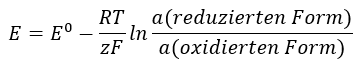
In der Gleichung erscheinen die folgenden Symbole: Elektrodenpotential (E), Standardpotential der Elektrode (E0), Gaskonstante (R) gleich 8,312 J/K.mol, Temperatur (T), Anzahl der in der elektrochemischen Reaktion vorhandenen Elektronen (z), Faraday-Konstante (F) gleich 9,64853.104 C/mol und die Ionenaktivitäten der reduzierten Form und der oxidierten Form. Für Feststoffe wird die Aktivität (a) mit 1 angenommen.

Potentiometrische Apparatur
Die Grundausstattung für potentiometrische Messungen besteht aus zwei Teilen: einem Paar Elektroden, die in die zu prüfende Lösung getaucht werden, und einem Messgerät. Der erste Teil bildet die Messzelle, während der zweite Teil die korrekte Messung ihrer elektromotorischen Kraft ermöglicht. Der wichtigste Teil der Zelle sind die Elektroden. Hinsichtlich ihrer Wirkungsweise lassen sie sich in vier Gruppen einteilen.
Elektrolytischer Schlüssel
Ein wichtiger Bestandteil eines jeden Zellensystems ist der elektrolytische Schlüssel, der den Kontakt zwischen der Vergleichselektrode und der zu prüfenden Lösung ermöglicht. Die grundlegende Eigenschaft einer Übertragungszelle ist der Kontakt zwischen Elektrolyten unterschiedlicher Konzentrationen und Zusammensetzungen. Um zu verhindern, dass sich der Elektrolyt des Schlüssels mit der zu prüfenden Lösung vermischt, werden kleine Kontaktflächen verwendet.
Elektroden erster Art
Das sind Elektroden gebaut aus Metall oder Gas, die in eine Lösung ihrer eigenen Ionen eingetaucht sind. Sie werden auch als dem Kation gegenüber reversible Elektroden bezeichnet, da an ihnen eine reversible Reaktion abläuft:
M0 ↔ Mn+ + ne
Ein Beispiel für die Elektroden erster Art ist die Wasserstoffelektrode.
Elektroden zweiter Art
Solche Elektroden bestehen aus einem Metall, das mit seinem schwerlöslichen Salz beschichtet ist. Das System wird in ein gut lösliches Salz getaucht, das das gleiche Anion hat wie das schwerlösliche Salz. Sie werden als reversible Elektroden in Bezug auf das gemeinsame Anion bezeichnet, weil an ihnen folgende Reaktion abläuft:
M0 + A– ↔ MA + e
Beispiele für Elektroden der zweiten Art sind die Chlorsilberelektrode und die Kalomelelektrode.
Elektroden dritter Art
Sie bestehen aus Metallen, die von zwei Schichten umgeben sind: einer dünnen Schicht aus einem schwer löslichen Salz dieses Metalls und einer zweiten Schicht aus einem etwas besser löslichen Salz, das das gleiche Anion enthält. Das sind reversible Elektroden in Bezug auf das gemeinsame Kation, da an ihnen folgende Reaktion abläuft:
M0(a) + M(b)A ↔ M(a)A + M+(b) + e

Arbeitselektroden (Redoxelektroden)
Die Konstruktion solcher Elektroden zeichnet sich durch die Verwendung eines chemisch inerten Metalls wie Platin oder Gold aus, das in eine Lösung getaucht wird, die die Substanz sowohl in reduzierter als auch in oxidierter Form enthält. Ein Beispiel für eine solche Elektrode ist die Chinhydronelektrode.
Funktionen der Elektroden im System
Aus der Sicht der Anwendung in einem analytischen System können Elektroden sein:
- Vergleichselektroden, auch Referenzelektroden genannt. Dies sind diejenigen Elektroden, die ein konstantes Potenzial aufrechterhalten, das von den Messbedingungen oder der Konzentration der zu prüfenden Lösung nicht beeinflusst wird.
- Indikatorelektroden, die mit einer Potentialänderung reagieren, wenn Ionen, für die sie empfindlich sind, in der zu prüfenden Lösung nachgewiesen werden.
Vergleichselektroden
Die potentiometrische Messung beruht auf dem Vergleich des Potentials einer Indikatorelektrode mit einer Referenzelektrode. Aus diesem Grund müssen solche Elektroden gekennzeichnet sein durch:
- Konstante des Potenzials,
- Reproduzierbarkeit des Potenzials und das Fehlen einer Temperaturabhängigkeit,
- Vielseitigkeit der Anwendungen und einfache Handhabung,
- geringen elektrischen Widerstand,
- reproduzierbares und niedriges Diffusionspotenzial,
- geringen Elektrolytausfluss in die Testlösung.
Eine häufig verwendete Vergleichselektrode ist die Chlorsilberelektrode Ag/AgCl/KCl, die auf die Anwesenheit von Chloridionen reagiert. Sie besteht aus Silberdraht, der mit einer Silberchloridschicht überzogen ist. Ein weiteres Beispiel ist die Kalomelelektrode Pt/Hg/Hg2Cl2/KCl, deren Potenzial ebenfalls von der Aktivität von Chloridionen in der Lösung abhängig ist.
Indikatorelektroden
Elektroden dieser Kategorie zeigen eine Potenzialänderung in Gegenwart der untersuchten Ionen in der Lösung. Das bedeutet, dass ihr Potenzial direkt von der Aktivität und damit der Konzentration der Lösung abhängt, in der sie sich befinden. Die am häufigsten verwendeten Elektroden sind solche, die in Lösungen ihrer eigenen Ionen eingetaucht sind, wie z. B. Silber-, Quecksilber- und Wasserstoffelektroden. Die moderne Potentiometrie verwendet jedoch ionenselektive Membranelektroden. Sie weisen folgende Gemeinsamkeiten auf: der aktive Teil ist die Membran, die Ionenreaktion zwischen den Ionen der Lösung und der Membran bestimmt die Potenzialdifferenz an der Grenzfläche zwischen diesen Phasen. Solche Elektroden können nach ihrer Bauweise unterteilt werden in Glaselektroden, Elektroden mit festen Membranen, Elektroden mit Flüssigmembranen und Elektroden mit Doppelmembranen. Die am häufigsten verwendeten Elektroden sind Glaselektroden, deren Aufbau aus einem Glasrohr besteht, das in einer dünnwandigen Blase aus Elektrodenglas endet. Darin befindet sich eine Innenelektrode – eine Chlorsilberelektrode, die in eine interne Lösung mit konstanter Ionenaktivität eingetaucht ist.
