Je to jedna z najstarších inštrumentálnych metód používaných v chemickej analýze. Jeho základy položili L. Galvani, CA Volta, JW Gibbs a W. Nernst medzi 18. a 19. storočím. Merania vykonávané potenciometrickými metódami využívajú elektromotorickú silu (EMF) článku zostaveného z dvoch elektród ponorených do testovaného roztoku. Hodnota tejto sily priamo závisí od potenciálov použitých elektród. Tie zase závisia od aktivity iónov obsiahnutých v roztoku elektrolytu a od povahy elektródových procesov.
Schéma elektródových procesov na príklade Daniellovho článku
Daniellov článok je vyrobený z dvoch poločlánkov, z ktorých každý pozostáva z kovu ponoreného do roztoku vlastnej soli. Zložkovými poločlánkami sú systémy Cu (s) /Cu2 + (aq) a Zn (s) /Zn2 + (aq) . Každý z nich prechádza jednou z nasledujúcich redoxných reakcií:
- zníženie
Cu 2+ (aq) + 2e – → Cu (s)
- oxidácia
Zn (s) → Zn 2+ (aq) + 2e – Keď skombinujeme obe reakcie, dostaneme úplnú rovnicu pre reakciu prebiehajúcu v bunke: Zn (s) + Cu 2+ (aq) + 2e – → Zn 2 + (aq) + 2e – + Cu (s) Na meranie konkrétnej elektromotorickej sily článku musíme poločlánky prepojiť soľným mostíkom a pripojiť elektródy k voltmetru . Môžeme tak merať rozdiel potenciálov medzi jednotlivými elektródami, ktorý predstavuje hodnotu EMF článku . Podľa konvencie IUPAC vyzerá diagram Daniellovej bunky nasledovne: ϴ Zn|Zn 2+ ||Cu 2+ |Cu ⊕ Jednoduché čiary predstavujú rozhranie a dvojité čiary predstavujú soľný mostík. Potenciál na rozhraní je výsledkom oxidačných a redukčných reakcií. Pre články predpokladáme, že elektróda, kde dochádza k oxidácii, je anóda so znamienkom ϴ, zatiaľ čo druhá je kladná katóda, kde dochádza k redukcii . Zápis začína anódou a katóda je uvedená na pravej strane . Elektromotorickú silu takéhoto článku možno vypočítať na základe nasledujúceho vzorca: EMF = katódový potenciál – anódový potenciál
Štandardný elektródový potenciál
Tento termín bol zavedený pre systematizáciu a určený potenciál elektródy sa považuje za „štandardný“, ak spĺňa niekoľko podmienok. Meranie by sa malo vykonávať pri 298 K, aktivita aktívnych iónov sa musí rovnať 1 mol/dm 3 a referenčnou elektródou musí byť štandardná vodíková elektróda, pretože sa predpokladá, že potenciál tejto elektródy je 0,0000 V.
Elektromotorická sila článku
Hodnota EMF sa mení spolu s meniacou sa aktivitou iónov prítomných v bunke. Rovnica, ktorá odráža tento vzťah, sa nazýva Nernstova rovnica : 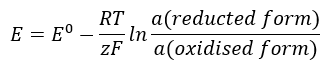 Používa tieto symboly: elektródový potenciál (E), štandardný elektródový potenciál (E 0 ), plynová konštanta (R) rovná 8,312 J/K·mol, teplota (T), počet elektrónov zapojených do elektrochemickej reakcie elektrónov. (z), Faradayova konštanta (F) rovná 9,64853·10 4 C/mol a aktivita iónov v redukovanej a oxidovanej forme. Pre tuhé látky sa predpokladá, že aktivita (a) je 1.
Používa tieto symboly: elektródový potenciál (E), štandardný elektródový potenciál (E 0 ), plynová konštanta (R) rovná 8,312 J/K·mol, teplota (T), počet elektrónov zapojených do elektrochemickej reakcie elektrónov. (z), Faradayova konštanta (F) rovná 9,64853·10 4 C/mol a aktivita iónov v redukovanej a oxidovanej forme. Pre tuhé látky sa predpokladá, že aktivita (a) je 1. 
Potenciometrické prístrojové vybavenie
Základná súprava pre potenciometrické merania pozostáva z dvoch komponentov: dvojice elektród ponorených v testovanom roztoku a meracieho prístroja . Prvým komponentom je merací článok , druhý umožňuje samotné meranie jeho elektromotorickej sily. Najdôležitejšou časťou článku sú elektródy. Podľa mechanizmu účinku ich možno rozdeliť do štyroch skupín.
Soľný most
Dôležitým prvkom každého článku je soľný mostík, ktorý umožňuje kontakt referenčnej elektródy s testovaným roztokom . Základnou charakteristikou článku s prenosom je kontakt medzi elektrolytmi rôznych koncentrácií a zložení. Aby sa zabránilo zmiešaniu elektrolytu mostíka s testovaným roztokom, používajú sa malé kontaktné plochy.
Elektródy prvého druhu
Tieto elektródy sú vyrobené z kovu alebo plynu ponoreného do roztoku obsahujúceho ich vlastné ióny . Nazývajú sa aj elektródy reverzibilné na katión , keďže na ich povrchu prebieha nasledujúca reverzibilná reakcia: M 0 ↔ M n+ + ne Príkladom elektród prvého druhu je vodíková elektróda.
Elektródy druhého druhu
Takéto elektródy sú vyrobené z kovu pokrytého jeho ťažko rozpustnou soľou . Systém je ponorený do voľne rozpustnej soli, ktorá obsahuje rovnaký anión ako ťažko rozpustná soľ. Tieto elektródy sa nazývajú elektródy reverzibilné na spoločný anión , pretože na ich povrchu prebieha reakcia: M 0 + A – ↔ MA + e Príklady elektród druhého druhu zahŕňajú elektródy striebro-chlorid strieborný alebo kalomelové elektródy.
Elektródy tretieho druhu
Sú zložené z kovov obklopených dvoma vrstvami: prvá, tenká vrstva vyrobená z ťažko rozpustnej soli tohto kovu a druhá vrstva vyrobená z trochu lepšie rozpustnej soli, ktorá obsahuje rovnaký anión. Sú to elektródy reverzibilné na spoločný katión , keďže na ich povrchu prebieha reakcia: M 0 (a) + M (b) A ↔ M (a) A + M + (b) + e 
Redoxné elektródy
Štruktúra takýchto elektród je charakterizovaná použitím chemicky inertného kovu, napríklad platiny alebo zlata, ktorý je ponorený do roztoku obsahujúceho látku v redukovanej aj oxidovanej forme. Príkladom takýchto elektród je chinhydronová elektróda.
Funkcie elektród v systéme
Z hľadiska aplikácie v analytickom systéme rozlišujeme:
- referenčné elektródy , ktoré udržujú konštantný potenciál bez ohľadu na podmienky merania alebo koncentráciu testovaného roztoku.
- indikačné elektródy , ktorých potenciál sa mení, ak testovaný roztok obsahuje ióny, na ktoré sú citlivé.
Referenčné elektródy
Potenciometrické meranie je založené na porovnaní potenciálu indikačnej elektródy s referenčnou elektródou . Z tohto dôvodu musia byť takéto elektródy charakterizované:
- stabilný potenciál,
- reprodukovateľný potenciál a teplotná nezávislosť,
- všestrannosť a jednoduchosť použitia,
- nízky elektrický odpor,
- reprodukovateľný a nízky difúzny potenciál,
- malý prietok elektrolytu elektródy do testovaného roztoku.
Bežne používanou referenčnou elektródou je elektróda striebro-chlorid strieborný (Ag/AgCl/KCl), ktorá reaguje na prítomnosť chloridových iónov. Je vyrobený zo strieborného drôtu potiahnutého vrstvou chloridu strieborného. Ďalším príkladom je kalomelová elektróda (Pt/Hg/ Hg2Cl2 /KCl), ktorej potenciál závisí aj od aktivity v roztoku chloridových iónov.
Indikátorové elektródy
U elektród z tejto kategórie sa ich potenciál mení v prítomnosti testovaných iónov v roztoku . To znamená, že ich potenciál priamo závisí od aktivity, teda aj koncentrácie roztoku, v ktorom sú umiestnené . Najčastejšie sa používajú elektródy ponorené do roztokov vlastných iónov, ako sú strieborné, ortuťové alebo vodíkové elektródy. V modernej potenciometrii sa však používajú iónovo selektívne membránové elektródy. Majú niektoré spoločné charakteristiky, napríklad ich aktívnou súčasťou je membrána a iónová reakcia medzi iónmi z roztoku a membrány určuje rozdiel potenciálu na ich rozhraní. Takéto elektródy je možné rozdeliť na základe ich štruktúry na sklenené, pevné membránové, kvapalné membránové a dvojmembránové elektródy. Najčastejšie sa používajú sklenené elektródy, ktoré sú vyrobené zo sklenenej trubice zakončenej tenkostennou bankou z elektródového skla. Umiestňuje vnútornú elektródu z chloridu strieborného a chloridu strieborného ponorenú do vnútorného roztoku s konštantnou aktivitou iónov.

