To jedna z najstarszych metod instrumentalnych wykorzystywanych w analizie chemicznej. Podwaliny tej metody stworzyli L. Galvani, C.A. Volta, J.W. Gibbs oraz W. Nernst pomiędzy XVIII a XIX wiekiem. Metody potencjometryczne wykorzystują w trakcie pomiarów siły elektromotoryczne (SEM) ogniwa zbudowanego z dwóch elektrod zanurzonych w badanym roztworze. Wartość tej siły zależy bezpośrednio od potencjałów zastosowanych elektrod. Te z kolei zależą od aktywności jonów znajdujących się w roztworze elektrolitu i od charakteru procesów elektrodowych.
Schemat procesów elektrodowych na przykładzie ogniwa Daniella
Ogniwo Daniella zbudowane jest z dwóch półogniw, każde z nich składa się z metalu zanurzonego w roztworze swojej soli. Półogniwa budujące to układ Cu(s)/Cu2+(aq) oraz Zn(s)/Zn2+(aq). Na każdym z nich zachodzi jedna z reakcji redoks:
- proces redukcji
Cu2+(aq) + 2e– → Cu(s)
- proces utleniania
Zn(s) → Zn2+(aq) + 2e–
Łącząc obydwie reakcje, otrzymujemy pełne równanie reakcji zachodzącej w ogniwie:
Zn(s) + Cu2+(aq) + 2e– → Zn2+(aq) + 2e– + Cu(s)
W celu zmierzenia interesującej nas siły elektromotorycznej ogniwa koniecznym jest połączenie półogniw kluczem elektrolitycznym oraz podłączenie elektrod do woltomierza. Pozwala nam to na zmierzenie różnicy potencjałów poszczególnych elektrod, która stanowi wartość SEM ogniwa. Zgodnie z konwencją IUPAC schemat ogniwa Daniella wygląda następująco:
ϴZn|Zn2+||Cu2+|Cu⊕
Pojedyncze linie symbolizują granicę faz, a podwójna – klucz elektrolityczny. Występujący na granicy faz potencjał jest skutkiem przebiegających reakcji utleniania i redukcji. W ogniwach przyjmuje się, że elektroda, na której zachodzi utlenianie, jest anodą o znaku ϴ, a druga elektroda to dodatnia katoda, na której zachodzi reakcja redukcji. W schemacie zapis rozpoczyna się od anody, po prawej zapisuje się natomiast katodę. Siłę elektromotoryczną takiego ogniwa można obliczyć ze wzoru:
SEM = potencjał katody – potencjał anody
Standardowy potencjał elektrod
W celu odpowiedniego usystematyzowania wprowadzono to pojęcie, a wyznaczony potencjał elektrody, aby był standardowym, musi spełnić kilka warunków. Pomiar należy przeprowadzić w temperaturze 298 K, aktywność jonów czynnych musi być równa 1 mol/dm3 oraz konieczne jest zastosowanie standardowej elektrody wodorowej jako elektrody odniesienia. Przyjmuje się bowiem, że potencjał tej elektrody wynosi 0,0000 V.
Siła elektromotoryczna ogniwa
Wartość SEM zmienia się wraz ze zmianą aktywności występujących w ogniwie jonów. Równanie, które odzwierciedla tę zależność, nazywa się równaniem Nernsta:
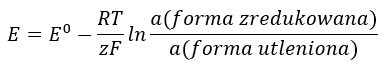
W równaniu pojawiają się symbole: potencjału elektrody (E), standardowego potencjału elektrody (E0), stałej gazowej (R) równej 8,312 J/K·mol, temperatury (T), liczby obecnych w reakcji elektrochemicznej elektronów (z), stałej Faradaya (F) równej 9,64853·104 C/mol, a także aktywności jonów formy zredukowanej i formy utlenionej. Dla ciał stałych aktywność (a) przyjmuje się jako 1.

Aparatura potencjometryczna
Podstawowy zestaw do pomiaru potencjometrycznego składa się z dwóch części – pary elektrod zanurzonych w badanym roztworze oraz z miernika. Pierwsza część stanowi ogniwo pomiarowe, natomiast druga pozwala na właściwy pomiar jego siły elektromotorycznej. Najważniejszym elementem ogniwa są elektrody. Ze względu na mechanizm działania można je podzielić na cztery grupy.
Klucz elektrolityczny
Ważnym elementem każdego układu ogniwa jest klucz elektrolityczny, który pozwala na kontakt elektrody porównawczej z badanym roztworem. Podstawową właściwością ogniwa z przenoszeniem jest kontakt pomiędzy elektrolitami o różnych stężeniach i składach. W celu niemieszania się elektrolitu klucza z badanym roztworem stosuje się małe powierzchnie styku.
Elektrody pierwszego rodzaju
Są to elektrody zbudowane z metalu lub gazu, zanurzonych w roztworze własnych jonów. Inaczej nazywa się je elektrodami odwracalnymi względem kationu, ponieważ przebiega na nich reakcja odwracalna:
M0 ↔ Mn+ + ne
Przykładem elektrody pierwszego rodzaju jest elektroda wodorowa.
Elektrody drugiego rodzaju
Takie elektrody są zbudowane z metalu pokrytego jego trudno rozpuszczalną solą. Układ jest zanurzony w dobrze rozpuszczalnej soli, która posiada ten sam anion co sól trudno rozpuszczalna. Nazywa się je elektrodami odwracalnymi względem wspólnego anionu, ponieważ przebiega na nich reakcja:
M0 + A– ↔ MA + e
Przykładami elektrod drugiego rodzaju są elektroda chlorosrebrowa oraz kalomelowa.
Elektrody trzeciego rodzaju
Tworzą je metale otoczone dwoma warstwami – pierwszą, cienką warstwą trudno rozpuszczalnej soli tego metalu oraz drugą, nieco lepiej rozpuszczalnej soli, która zawiera ten sam anion. Są to elektrody odwracalne względem wspólnego kationu, ponieważ przebiega na nich reakcja:
M0(a) + M(b)A ↔ M(a)A + M+(b) + e

Elektrody utleniająco-redukujące
Budowa elektrod tego typu charakteryzuje się zastosowaniem obojętnego chemicznie metalu, na przykład platyny lub złota, który zanurza się w roztworze zawierającym substancję zarówno w formie zredukowanej, jak i utlenionej. Przykładem takiej elektrody jest elektroda chinhydronowa.
Funkcje elektrod w układzie
Z punktu widzenia zastosowania w układzie analitycznym, elektrody mogą być:
- porównawcze, nazywane też elektrodami odniesienia. To takie elektrody, które zachowują stały potencjał bez wpływu warunków pomiaru ani stężenia badanego roztworu.
- wskaźnikowe, które reagują zmianą potencjału w przypadku wykrycia w badanym roztworze jonów, na które są czułe.
Elektrody porównawcze
Pomiar potencjometryczny opiera się na porównaniu potencjału elektrody wskaźnikowej z elektrodą odniesienia. Z tego względu takie elektrody muszą się cechować:
- stałością potencjału,
- odtwarzalnością potencjału oraz brakiem zależności temperaturowej,
- uniwersalnością zastosowań i łatwym użyciem,
- małym oporem elektrycznym,
- odtwarzalnym i niskim potencjałem dyfuzyjnym,
- niewielkim wypływem elektrolitu elektrody do badanego roztworu.
Powszechnie stosowaną elektrodą porównawczą jest elektroda chlorosrebrowa Ag/AgCl/KCl, która reaguje na obecność jonów chlorkowych. Zbudowana jest ze srebrnego drutu pokrytego warstwą chlorku srebra. Innym przykładem jest elektroda kalomelowa Pt/Hg/Hg2Cl2/KCl, której potencjał jest również zależny od aktywności w roztworze jonów chlorkowych.
Elektrody wskaźnikowe
Elektrody tej kategorii wykazują zmianę potencjału wobec obecności badanych jonów w roztworze. Oznacza to, że ich potencjał jest bezpośrednio zależny od aktywności, a więc i stężenia roztworu, w którym się znajdują. Najczęściej stosowane są elektrody zanurzone w roztworach własnych jonów, takie jak elektroda srebrowa, rtęciowa i wodorowa. Jednak we współczesnej potencjometrii wykorzystuje się jonoselektywne elektrody membranowe. Posiadają one wspólne cechy, takie jak: czynną częścią jest membrana, reakcja jonowa między jonami z roztworu i membrana decyduje o różnicy potencjału na granicy tych faz. Takie elektrody można podzielić ze względu na budowę na: szklane, ze stałymi membranami, z ciekłymi membranami oraz z podwójnymi membranami. Najczęściej stosowane są elektrody szklane, których konstrukcja składa się z rurki szklanej zakończonej cienkościenną banieczką ze szkła elektrodowego. Wewnątrz niej umieszczona jest elektroda wewnętrzna – chlorosrebrowa zanurzona w roztworze wewnętrznym o stałej aktywności jonów.
