คำว่า “องค์ประกอบ” อ้างอิงถึงอะตอมซึ่งนิวเคลียสประกอบด้วยโปรตอนเป็นจำนวนเฉพาะ นอกเหนือจากนั้น นิวเคลียสของอะตอมยังประกอบด้วยโมเลกุลอื่นๆ อีกด้วย: นิวตรอน จำนวนของพวกเขาภายในองค์ประกอบเดียวอาจแตกต่างกันไป ในกรณีเช่นนี้ เราพูดถึงไอโซโทป กล่าวคือ การแปรผันของธาตุที่กำหนดซึ่งมีจำนวนนิวตรอนต่างกันในนิวเคลียส ดังนั้น เลขมวลของพวกมันจึงแตกต่างกันด้วย อย่างไรก็ตาม เลขอะตอมยังคงที่ เนื่องจากจำนวนอิเล็กตรอนบนเปลือกอิเล็กตรอนยังคงไม่เปลี่ยนแปลง

ด้วยเหตุนี้ ไอโซโทปของธาตุชนิดเดียวกันจึงมีตำแหน่งเดียวกันในตารางธาตุ และแต่ละไอโซโทปมีขนาดเท่ากัน นอกจากนี้คุณสมบัติทางเคมีและกายภาพยังคล้ายคลึงกันอีกด้วย อย่างไรก็ตาม มีข้อยกเว้นโดยเฉพาะอย่างยิ่งคุณสมบัติทางกายภาพที่หลากหลายมากขึ้น ซึ่งมักจะเกิดขึ้นเมื่อเราจัดการกับไอโซโทปสองไอโซโทปที่มีมวลแตกต่างกันอย่างมีนัยสำคัญ นี่เป็นเพราะมวลที่กำหนดคุณสมบัติทั้งหมด เช่น ความหนาแน่นหรือความเร็วการแพร่กระจายของอนุภาค ในทางตรงกันข้าม พารามิเตอร์ต่างๆ เช่น การนำไฟฟ้าหรือสีไม่ได้ขึ้นอยู่กับมวล ความหลากหลายของคุณสมบัติทางเคมีมักมาจากความเร็วปฏิกิริยาที่ไม่เท่ากันของไอโซโทปต่างๆ
นิวไคลด์กับไอโซโทป
มีแนวคิดที่เกี่ยวข้องกับไอโซโทปซึ่งเป็นข้อมูลทั่วไปมากกว่า นิวไคลด์คืออะตอมทั้งชุดที่มีโครงสร้างนิวเคลียร์ถูกกำหนดโดยจำนวนโปรตอนและนิวตรอนโดยเฉพาะ ซึ่งหมายความว่านิวไคลด์สองตัวที่มีจำนวนนิวตรอนต่างกันสามารถเป็นไอโซโทปได้ ในทางปฏิบัติ ไอโซโทปทั้งหมดเป็นนิวไคลด์ แต่ไม่ใช่ทุกนิวไคลด์ที่จำเป็นต้องเป็นไอโซโทป แนวคิดหลักที่อยู่เบื้องหลังแนวคิดทั้งสองนี้ครอบคลุมคุณสมบัติทางเคมีในกรณีของไอโซโทปและคุณสมบัติทางนิวเคลียร์ในกรณีของนิวไคลด์ ตัวอย่างเช่น:
- นิวไคลด์ซึ่งเป็นไอโซโทป:
- นิวไคลด์ที่ไม่ใช่ไอโซโทป:
ไอโซโทปในธรรมชาติ
องค์ประกอบทางเคมีที่มีอยู่ในสภาพแวดล้อมทางธรรมชาติเป็นส่วนผสมของไอโซโทปที่มีองค์ประกอบเป็นเปอร์เซ็นต์คงที่ ขึ้นอยู่กับนิวเคลียส ธาตุสามารถประกอบด้วยหนึ่ง ไอโซโทปหลายไอโซโทปหรือมากกว่านั้น บางคนมีความเสถียร แต่บางคนก็เปลี่ยนอย่างรวดเร็ว การสลายตัวดังกล่าวอาจสร้างไอโซโทปของธาตุเดียวกันหรือต่างกัน การเปลี่ยนแปลงดังกล่าวมักจะไปพร้อมกับการแผ่รังสี หากต้องการใช้ค่าเฉพาะ บนโลกมีธาตุที่มีเลขอะตอมเท่ากับหรือต่ำกว่า 92 ธาตุที่มีเลขสูงถึง 83 ถือว่าเสถียร มีธาตุที่มีอยู่ตามธรรมชาติมากถึง 81 ชนิดที่มีไอโซโทปที่เสถียร เหล่านี้รวมถึงซิลิคอนที่มีไอโซโทป 28 Si, 29 Si และ 30 Si, เหล็กที่มีไอโซโทป 54 Fe, 56 Fe, 57 Fe และ 58 Fe หรืออะลูมิเนียมซึ่งมีไอโซโทปเสถียรเพียงไอโซโทปเดียว: 27 Al
ไอโซโทปไฮโดรเจน
ในธรรมชาติ เราสามารถพบไอโซโทปของไฮโดรเจนสามชนิดที่เป็นส่วนผสมของธาตุ ในทางปฏิบัติ ไอโซโทป 1 H (ไฮโดรเจน-1) และ 2 H (ไฮโดรเจน-2) เป็นตัวแทนส่วนใหญ่ตามลำดับ 99.985%และ 0.015%ของการเกิดไฮโดรเจนทั้งหมด ไอโซโทป 3 H (ไฮโดรเจน-3) ไม่เสถียรและแสดงปริมาณเพียงเล็กน้อยเท่านั้น ไฮโดรเจน-1 เป็นโปรเทียมที่รู้จักกันดีที่สุด ไฮโดรเจน-2 (เรียกอีกอย่างว่าดิวทีเรียม) ประกอบด้วยโปรตอน 1 ตัวและนิวตรอน 1 ตัว ในขณะที่นิวเคลียสของไอโซโทปสุดท้าย (ไฮโดรเจน-3 เช่น ทริเทียม) ประกอบด้วยโปรตอน 1 ตัวและนิวตรอน 2 ตัว ด้วยเหตุนี้ ความแตกต่างของมวลระหว่างไอโซโทปเหล่านี้จึงมีความสำคัญ: อะตอมของดิวทีเรียมหนักเป็นสองเท่าของโปรเทียม ในขณะที่ไอโซโทปหนักกว่าโปรเทียมถึงสามเท่า ดังที่เราทราบ ไฮโดรเจนในรูปแบบไอโซโทปใดๆ มีอยู่ในรูปของโมเลกุลไดอะตอมมิก ปรากฎว่ามันอาจสร้างโมเลกุลที่มีไอโซโทปต่างๆ เช่น HD (โปรเทียม-ดิวเทอเรียม), HT (โปรเทียม-ทริเทียม) และ DT (ดิวทีเรียม-ทริเทียม) ดิวทีเรียมเป็นไอโซโทปที่ไม่มีกัมมันตภาพรังสีและมีความเสถียรสูง บางครั้งเรียกว่าไฮโดรเจนหนัก ถ้าเราแทนที่ไฮโดรเจน-1 ด้วยดิวเทอเรียมในโมเลกุลของน้ำ (D 2 O) โมเลกุลจะเปลี่ยนคุณสมบัติ จุดหลอมเหลวจะเพิ่มขึ้นประมาณ 1.5 o C และจุดเยือกแข็งจะลดลงมากถึง 3.81 o C ความหนาแน่นของมันจะเพิ่มขึ้นเมื่อเทียบกับ H 2 O ประมาณ 0.1%ในทางตรงกันข้าม ทริเทียมเป็นไอโซโทปที่ไม่เสถียรสูงซึ่งมีกัมมันตภาพรังสีด้วย นิวเคลียสของมันคือสถานที่ของการสลายตัวของสารกัมมันตภาพรังสีที่เกิดขึ้นเองซึ่งผลิตอะตอมของฮีเลียม หากเราเปรียบเทียบคุณสมบัติทางเคมีฟิสิกส์ของไอโซโทป เราจะพบความแตกต่างที่สำคัญซึ่งแสดงไว้ในตารางที่ 1 ตารางที่ 1 การเปรียบเทียบค่าพารามิเตอร์พื้นฐานทางเคมีฟิสิกส์ของไอโซโทปไฮโดรเจน
| ไอโซโทป | เครื่องหมาย | ความหนาแน่น [g /l] | จุดหลอมเหลว [K] | จุดเดือด [K] |
| โพรเทียม | ชม | 0.08233 | 13.83 น | 20.27 น |
| ดิวทีเรียม | ง | 0.1645 | 18.73 น | 23.67 น |
| ไอโซโทป | ต | 0.2464 | 20.62 น | 25.04 น |
ไอโซโทปของคาร์บอน
คาร์บอนมีไอโซโทปที่รู้จักกันสามชนิด: 12 C, 13 C และ 14 C ซึ่งแต่ละไอโซโทปมีคุณสมบัติทางเคมีเหมือนกัน ที่พบมากที่สุดคือคาร์บอน-12 ซึ่งคิดเป็น 98.89%ของอะตอมทั้งหมด ไอโซโทป 13 C ที่มีอยู่บนโลกคิดเป็นประมาณ 1.11%ในขณะที่อะตอม 14 C เกิดขึ้นในหนึ่งอะตอมต่อประมาณ 10 12 อันหลังมีแนวโน้มที่จะสลายตัวได้เองซึ่งทำให้เกิดการปลดปล่อยรังสีบีตา จากนั้นไอโซโทปจะเปลี่ยนเป็นอะตอมของไนโตรเจน ไอโซโทปที่เสถียรคือคาร์บอน-13 เนื่องจากการหมุนที่ไม่เป็นศูนย์จึงสามารถนำมาใช้ในเรโซแนนซ์แม่เหล็กนิวเคลียร์ 13 NMR
การประยุกต์ใช้ไอโซโทป
ในอุปกรณ์ตรวจจับควัน เราใช้ไอโซโทปที่ไม่เสถียร 241 Am หรือ 238 Pu ซึ่งมีลักษณะการสลายตัวช้าร่วมกับการปล่อยรังสี เมื่อควันปรากฏขึ้น การแผ่รังสีจะถูกปิดกั้นและไม่ไปถึงเครื่องตรวจจับอีกต่อไป ซึ่งจะทำให้สัญญาณเตือนทำงาน รังสีจากการสลายตัวของธาตุบางชนิดสามารถทำลายจุลินทรีย์ได้ ดังนั้นไอโซโทปต่างๆ รวมถึง 60 Co จึงอาจใช้ในการถนอมอาหารได้ ในการวินิจฉัยทางการแพทย์ นิวเคลียสบางอย่างถูกใช้เพื่อตรวจหาการเปลี่ยนแปลงในอวัยวะที่ทดสอบ เช่น ในไตหรือในหัวใจ ไอโซโทปดังกล่าวรวมกับสารที่ไม่ใช้งานทางชีวภาพกับเส้นทางที่รู้จักในร่างกายและแนะนำให้รู้จักกับระบบการไหลเวียนโลหิต สิ่งนี้ทำให้สามารถติดตามเส้นทางของรังสีและสังเกตขณะที่มันสะสมอยู่ในเนื้อเยื่อและอวัยวะต่างๆ ในการรักษาเนื้องอก เรายังใช้รังสีรักษาตามการปล่อยรังสีจากไอโซโทปที่ไม่เสถียร เช่น 226 Ra และ 60 Co เป้าหมายของการบำบัดดังกล่าวคือการทำลายเซลล์เนื้องอก หนึ่งใน ไอโซโทปของคาร์บอน 14 C ถูกนำไปใช้ในการวิเคราะห์อายุของวัสดุที่มีต้นกำเนิดจากสารอินทรีย์ นิวเคลียสที่ไม่เสถียรนี้จะสลายตัวอย่างช้าๆ และหากสิ่งมีชีวิตตาย (ซึ่งเมื่อการดูดซึมคาร์บอนหยุดลง) ความเข้มข้นของคาร์บอน-14 จะลดลงตามสัดส่วนของปีที่ผ่านไป ไอโซโทปบางชนิด เช่น 239 Pu และ 235 U ใช้ในโรงไฟฟ้านิวเคลียร์ ในระหว่างการสลายตัวของนิวเคลียสที่ไม่เสถียรนั้น จะมีการผลิตพลังงานซึ่งอาจเปลี่ยนเป็นไฟฟ้าได้
มวลอะตอมและไอโซโทป
มวลอะตอมของธาตุที่แสดงในตารางธาตุคือมวลเฉลี่ย เมื่อเราคำนวณ เราจะพิจารณาจำนวน (n) และองค์ประกอบร้อยละ (x n ) ของแต่ละไอโซโทปขององค์ประกอบที่เป็นปัญหา ตามสูตรต่อไปนี้: 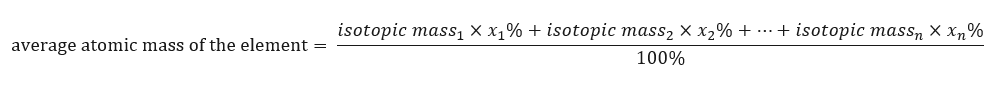 ตัวอย่างเช่น เมื่อคำนวณมวลอะตอมเฉลี่ยของไฮโดรเจน เราจะได้สมการต่อไปนี้:
ตัวอย่างเช่น เมื่อคำนวณมวลอะตอมเฉลี่ยของไฮโดรเจน เราจะได้สมการต่อไปนี้: 

