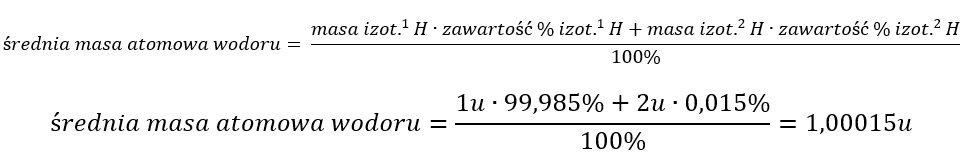Pojęciem pierwiastek nazywamy atomy, które posiadają konkretną liczbę protonów w jądrze. Oprócz nich, jądro atomowe składa się również z innych molekuł – neutronów. To ich liczba może być różna w obrębie jednego pierwiastka. W takim przypadku mówimy o izotopach, czyli odmianach danego pierwiastka, które posiadają odmienne liczby neutronów w swoim jądrze. Charakteryzują się zatem innymi liczbami masowymi. Liczba atomowa pozostaje jednak stała, gdyż ilość elektronów na powłokach elektronowych nie ulega zmianie. Z tego względu w układzie okresowym izotopy danego pierwiastka zajmują to samo miejsce, a każdy z nich charakteryzuje się takim samym rozmiarem.

Również ich właściwości chemiczne i fizyczne są do siebie zbliżone. Istnieją jednak wyjątki, gdzie zwłaszcza cechy fizyczne są bardziej zróżnicowane, zazwyczaj gdy rozważa się izotopy o dużych różnicach w masie. Dzieje się tak, gdyż to właśnie od masy zależy cały szereg właściwości, takie jak gęstość czy też szybkość dyfuzji cząstek. Nie zależą od niej natomiast takie parametry jak przewodnictwo elektryczne oraz barwa. Zróżnicowanie w przypadku właściwości chemicznych wynika zazwyczaj z niejednakowej szybkości w reakcji poszczególnych izotopów.
Nuklidy vs izotopy
Istnieje pojęcie, związane z izotopami, jednak nieco bardziej ogólne. Nuklidami nazywamy cały zbiór atomów, którego budowa jądra jest ściśle określona ilością protonów i neutronów. Oznacza to, że dwa nuklidy, różniące się liczbą neutronów mogą być izotopami. W praktyce, wszystkie izotopy są nuklidami, ale nie każde nuklidy muszą być izotopami. Główny zamysł tych dwóch pojęć obejmuje właściwości chemiczne w przypadku izotopów, a dla nuklidów – właściwości jądrowe. Dla przykładu:
- Nuklidy, które są izotopami:
- Nuklidy, które nie są jednocześnie izotopami:
Izotopy w przyrodzie
Występujące w naturze pierwiastki chemiczne są mieszaniną izotopów o stałym składzie procentowym. W zależności od jądra, w składzie może się znajdować jeden, kilka lub więcej izotopów. Część z nich jest stabilna, jednak niektóre bardzo szybko ulegają przemianom. W wyniku takiego rozpadu mogą powstawać izotopy tego samego lub innego pierwiastka. Takim przejściom zwyczajowo towarzyszy emisja promieniowania. Posługując się konkretnymi wartościami, istnieją na Ziemi pierwiastki o liczbach atomowych mniejszych bądź równych 92. Te, posiadające wartość maksymalnie do 83 uznaje się za trwałe. Naturalnie występuje aż 81 pierwiastków, które posiadają trwałe izotopy. Są to, między innymi krzem o izotopach 28Si, 29Si i 30Si, żelazo z izotopami 54Fe, 56Fe, 57Fe i 58Fe oraz glin posiadający wyłącznie jeden trwały izotop – 27Al.
Izotopy wodoru
W przyrodzie spotykane są trzy izotopy wodoru, tworzące mieszaninę pierwiastka. W praktyce, izotopy 1H (wodór-1) oraz 2H (wodór-2) stanowią większość, kolejno 99,985% oraz 0,015% całkowitego występowania wodoru. Izotop 3H (wodór-3) jest niestabilny i stanowi jedynie śladowe ilości. Wodór-1 stanowi najpowszechniej znany prot, wodór-2 nazywany inaczej deuterem zbudowany jest z jednego protonu i jednego neutronu, a ostatni izotop wodór-3, czyli tryt w jądrze posiada jeden proton oraz dwa neutrony. Z tego względu różnica mas pomiędzy nimi jest bardzo znacząca – atom deuteru ma dwukrotnie większą masę od protu, a tryt w porównaniu z protem aż trzykrotnie większą. Jak wiadomo, wodór w każdej postaci izotopowej występuje jako cząsteczka dwuatomowa. Okazuje się, że może również tworzyć cząsteczki zawierające różne izotopy, to znaczy typu HD (prot-deuter), HT (prot-tryt) oraz DT (deuter-tryt). Deuter jest izotopem nieradioaktywnym o wysokiej stabilności. Można spotkać go pod nazwą ciężkiego wodoru. Zastąpienie wodoru-1, deuterem w cząsteczce wody (D2O) powoduje zmianę jej właściwości – temperatura topnienia wzrasta o około 1,5oC, a zamarzania aż o 3,81oC. Jej gęstość jest również większa w przeciwieństwie do H2O, o około 0,1%. Tryt jest natomiast bardzo niestabilnym izotopem, wykazującym radioaktywność. W jego jądrze dochodzi do samorzutnych rozpadów promieniotwórczych, których wynikiem są atomy helu. Porównując właściwości fizykochemiczne izotopów, można znaleźć zasadnicze różnice widoczne w Tabeli 1.
Tabela 1. Porównanie podstawowych parametrów fizykochemicznych dla izotopów wodoru.
| Izotop | Symbol | Gęstość [g/l] | Temperatura topnienia [K] | Temperatura wrzenia [K] |
| Prot | H | 0,08233 | 13,83 | 20,27 |
| Deuter | D | 0,1645 | 18,73 | 23,67 |
| Tryt | T | 0,2464 | 20,62 | 25,04 |
Izotopy węgla
Pierwiastek węgiel posiada trzy znane nam izotopy: 12C, 13C oraz 14C i każdy z nich posiada takie same właściwości chemiczne. Najpowszechniej występuje węgiel-12, który stanowi aż 98,89% wszystkich atomów. Izotop 13C znajduje się na Ziemi w około 1,11%, a ostatni, atom 14C przypada jeden na około 1012. Ten ostatni, wykazuje predyspozycje do spontanicznego rozpadu, prowadząc do emisji promieniowania beta. Sam przekształca się wtedy do atomu azotu. Stabilnym izotopem jest natomiast węgiel-13. Ze względu na swój niezerowy spin, ten izotop może być stosowany w jądrowym rezonansie magnetycznym 13 NMR.
Zastosowanie izotopów
W detektorach dymu stosowane są nietrwałe izotopy 241Am lub 238Pu, które charakteryzuje powolny rozpad połączony z emisją promieniowania. W trakcie pojawiania się dymu dochodzi do blokady promieniowania, które przestaje docierać do detektora, powodując uruchomienie alarmu. Ze względu na zdolności promieniowania rozpadowego niektórych pierwiastków do niszczenia mikroorganizmów, izotopy, w tym 60Co mogą służyć do utrwalania żywności. W diagnostyce medycznej wykorzystuje się niektóre jądra w celu detekcji zmian w badanych organach, na przykład w nerkach czy w sercu. Taki izotop łączy się z nieaktywną biologicznie substancją o znanej drodze w organizmie i wprowadza do krwiobiegu. Pozwala to na śledzenie drogi promieniowania oraz obserwację jego gromadzenia się w tkankach i narządach. W leczeniu nowotworów również stosuje się radioterapię opartą na emisji promieniowania przez nietrwałe izotopy, takie jak 226Ra oraz 60Co. Celem takiej terapii jest wyniszczenie komórek nowotworowych. Jeden z izotopów węgla – 14C stosuje się do oznaczania wieku materiałów pochodzenia organicznego. To nietrwałe jądro ulega powolnemu rozpadowi, a w przypadku obumarcia organizmu, kiedy ustaje proces przyswajania węgla, maleje w nim stężenie węgla-14 proporcjonalnie do upływu lat. Niektóre izotopy, na przykład 239Pu i 235U wykorzystuje się w elektrowniach jądrowych. W trakcie rozpadu tych nietrwałych jąder dochodzi do wytwarzania energii, która z kolei może zostać zmieniona w energię elektryczną.
Masa atomowa a izotopy
Widoczna w układzie okresowym masa atomowa pierwiastków stanowi tak właściwie masę uśrednioną. Obliczając ją, bierze się pod uwagę ilość (n) oraz skład procentowy (xn) poszczególnych izotopów danego pierwiastka, według wzoru:
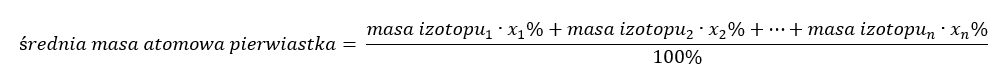
Przykładowo, obliczając średnią masę atomową wodoru otrzymamy następujące równanie: