Istilah "elemen" merujuk kepada atom yang nukleusnya mengandungi bilangan proton tertentu. Selain daripada mereka, nukleus atom juga terdiri daripada molekul lain: neutron. Nombor mereka dalam satu elemen mungkin berbeza-beza. Dalam kes sedemikian, kita bercakap tentang isotop tertentu, iaitu varian unsur yang mempunyai bilangan neutron yang berbeza dalam nukleusnya. Oleh itu, nombor jisim mereka juga berbeza. Walau bagaimanapun, nombor atom kekal malar, kerana bilangan elektron pada kulit elektron kekal tidak berubah.

Atas sebab ini, isotop unsur yang sama mempunyai kedudukan yang sama dalam jadual berkala, dan setiap satu daripadanya mempunyai saiz yang sama. Juga, sifat kimia dan fizikal mereka adalah serupa. Walau bagaimanapun, terdapat pengecualian di mana terutamanya sifat fizikal lebih pelbagai, yang biasanya berlaku apabila kita berurusan dengan dua isotop dengan perbezaan jisim yang ketara. Ini disebabkan oleh fakta bahawa jisim yang menentukan julat keseluruhan sifat seperti ketumpatan atau kelajuan resapan zarah. Sebaliknya, parameter seperti kekonduksian elektrik atau warna tidak bergantung pada jisim. Kepelbagaian sifat kimia biasanya datang daripada kelajuan tindak balas yang tidak sama dengan pelbagai isotop.
Nuklida vs isotop
Terdapat konsep yang dikaitkan dengan isotop, yang lebih generik. Nuklida ialah satu set keseluruhan atom yang struktur nuklearnya ditentukan secara khusus oleh bilangan proton dan neutron. Ini bermakna dua nuklida yang berbeza dalam bilangan neutron boleh menjadi isotop. Dalam amalan, semua isotop adalah nuklida tetapi tidak setiap nuklida semestinya isotop. Idea utama di sebalik kedua-dua konsep ini meliputi sifat kimia dalam kes isotop dan sifat nuklear dalam kes nuklida. sebagai contoh:
- Nuklida yang merupakan isotop:
- Nuklida yang bukan isotop:
Isotop di alam semula jadi
Unsur kimia yang wujud dalam persekitaran semula jadi ialah campuran isotop dengan komposisi peratusan yang tetap. Bergantung pada nukleus, unsur boleh mengandungi satu, beberapa atau lebih isotop. daripada mereka stabil, tetapi ada yang cepat berubah. Penguraian sedemikian boleh menghasilkan isotop unsur yang sama atau sama. Peralihan sedemikian biasanya berlaku bersama-sama dengan pelepasan sinaran. Untuk menggunakan nilai tertentu, di Bumi terdapat unsur yang nombor atomnya sama atau lebih rendah daripada 92. Mereka yang mempunyai nombor sehingga 83 dianggap stabil. Terdapat sebanyak 81 unsur sedia ada secara semula jadi yang mempunyai isotop stabil. Ini termasuk silikon, dengan isotop 28 Si, 29 Si dan 30 Si, besi, dengan isotop 54 Fe, 56 Fe, 57 Fe dan 58 Fe, atau aluminium, yang hanya mempunyai satu isotop stabil: 27 Al.
Isotop hidrogen
Secara semula jadi, kita boleh menemui tiga isotop hidrogen yang membentuk campuran unsur. Dalam amalan, isotop 1 H (hidrogen-1) dan 2 H (hidrogen-2) mewakili majoriti, masing-masing, 99.985 %dan 0.015 %daripada jumlah kejadian hidrogen. Isotop 3 H (hidrogen-3) tidak stabil dan hanya mewakili beberapa jumlah surih. Hidrogen-1 ialah protium yang paling terkenal, hidrogen-2 (juga dipanggil deuterium) diperbuat daripada satu proton dan satu neutron, manakala nukleus isotop terakhir (hidrogen-3, iaitu tritium) mengandungi satu proton dan dua neutron. Atas sebab ini, perbezaan jisim antara isotop ini adalah ketara: atom deuterium adalah dua kali lebih berat daripada protium, manakala tritium adalah tiga kali lebih berat daripada protium. Seperti yang kita ketahui, hidrogen dalam sebarang bentuk isotop wujud sebagai molekul diatomik. Ternyata ia juga mungkin membentuk molekul yang mengandungi isotop berbeza, iaitu HD (protium-deuterium), HT (protium-tritium) dan DT (deuterium-tritium). Deuterium ialah isotop bukan radioaktif, kestabilan tinggi. Ia kadangkala dirujuk sebagai berat hidrogen. Jika kita menggantikan hidrogen-1 dengan deuterium dalam molekul udara (D 2 O), molekul akan berubah sifatnya: takat lebur akan meningkat sekitar 1.5 o C dan takat beku akan turun sebanyak 3.81 o C. Ketumpatannya juga akan meningkat berbanding H 2 O sekitar 0.1 %. Sebaliknya, tritium ialah isotop yang sangat tidak stabil dan juga radioaktif. Nukleusnya ialah tempat penguraian radioaktif spontan yang menghasilkan atom helium. Jika kita membandingkan sifat fiziko-kimia isotop, kita akan menemui perbezaan penting, yang ditunjukkan dalam Jadual 1. Jadual 1. Perbandingan parameter fiziko-kimia asas isotop hidrogen.
| Isotop | Simbol | Ketumpatan [g /l] | Takat lebur [K] | Takat didih [K] |
| Protium | H | 0.08233 | 13.83 | 20.27 |
| Deuterium | D | 0.1645 | 18.73 | 23.67 |
| Tritium | T | 0.2464 | 20.62 | 25.04 |
Isotop karbon
Karbon mempunyai tiga isotop yang diketahui: 12 C, 13 C dan 14 C, setiap satunya mempunyai sifat kimia yang sama. Yang paling biasa ialah karbon-12, yang mewakili sebanyak 98.89 %daripada semua atom. Isotop 13 C yang wujud di Bumi mewakili sekitar 1.11%, manakala atom 14 C berlaku dalam satu per sekitar 10 12 . Yang terakhir terdedah kepada penguraian spontan, yang menyebabkan pancaran sinaran beta. Kemudian isotop berubah menjadi atom nitrogen. Isotop yang stabil ialah karbon-13. Oleh kerana putaran bukan sifarnya, ia boleh digunakan dalam resonans magnetik nuklear 13 NMR.
Penggunaan isotop
Dalam pengesanan secepat mungkin, kami menggunakan isotop tidak stabil, 241 Am atau 238 Pu, yang dicirikan oleh penguraian yang perlahan digabungkan dengan pancaran sinaran. Apabila asap muncul, sinaran disekat dan tidak lagi sampai ke pengesan, sekali gus mencetuskan penggera. Sinaran penguraian beberapa unsur mampu memusnahkan mikroorganisma, dan oleh itu isotop, termasuk 60 Co, boleh digunakan untuk mengawet makanan. Dalam diagnostik perubatan, nukleus tertentu digunakan untuk mengesan perubahan pada organ yang diuji, contohnya pada buah pinggang atau jantung. Isotop sedemikian bergabung dengan bahan tidak aktif secara biologi dengan laluan yang diketahui dalam badan dan memperkenalkannya kepada sistem peredaran darah. Ini membolehkan untuk mengesan laluan sinaran dan memerhati semasa ia terkumpul dalam tisu dan organ. Dalam rawatan tumor, kami menggunakan radioterapi berdasarkan pelepasan sinaran oleh isotop yang tidak stabil seperti 226 Ra dan 60 Co. Matlamat terapi sedemikian adalah untuk memusnahkan sel tumor. Salah satu isotop karbon, 14 C, digunakan untuk menguji umur bahan asal organik. Nukleus yang tidak stabil ini perlahan-lahan terurai, dan jika organisma mati (iaitu apabila asimilasi karbon berhenti), kadar karbon-14nya dikurangkan mengikut perkadaran pada tahun-tahun berlalu. Beberapa isotop, contohnya 239 Pu dan 235 U, digunakan dalam loji tenaga nuklear. Semasa penguraian nukleus yang tidak stabil itu, tenaga yang dihasilkan seterusnya boleh ditukar kepada elektrik.
Jisim atom dan isotop
Jisim atom unsur yang dibentangkan dalam jadual berkala sebenarnya adalah jisim purata. Apabila kita mengiranya, kita mengambil kira nombor (n) dan komposisi peratusan (x n ) bagi setiap isotop unsur berkenaan, mengikut formula berikut: 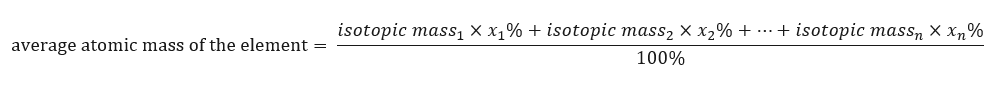 Sebagai contoh, apabila mengira purata jisim atom hidrogen, kita akan memperoleh persamaan berikut:
Sebagai contoh, apabila mengira purata jisim atom hidrogen, kita akan memperoleh persamaan berikut: 

