Der Begriff Element bezieht sich auf Atome, die eine konkrete Anzahl von Protonen im Kern haben. Neben diesen besteht der Atomkern auch aus anderen Molekülen, den Neutronen. Es ist ihre Anzahl, die innerhalb eines Elements variieren kann. In einem solchen Fall spricht man von Isotopen, d.h. von Varianten eines bestimmten Elements, die eine unterschiedliche Anzahl von Neutronen in ihrem Kern haben. Sie sind daher durch unterschiedliche Massenzahlen gekennzeichnet. Die Ordnungszahl bleibt jedoch konstant, da sich die Anzahl der Elektronen in den Elektronenschalen nicht ändert.

Daher nehmen die Isotope eines Elements im Periodensystem denselben Platz ein und jedes von ihnen ist durch dieselbe Größe gekennzeichnet. Auch ihre chemischen und physikalischen Eigenschaften sind ähnlich. Es gibt jedoch Ausnahmen, bei denen vor allem die physikalischen Eigenschaften differenzierter sind, in der Regel dann, wenn es sich um Isotope mit großen Massenunterschieden handelt. Das liegt daran, dass die Masse eine ganze Reihe von Eigenschaften bestimmt, etwa die Dichte oder die Diffusionsgeschwindigkeit der Teilchen. Dagegen sind Parameter wie die elektrische Leitfähigkeit und die Farbe nicht davon abhängig. Die Unterschiede in den chemischen Eigenschaften sind in der Regel auf die unterschiedlichen Reaktionsgeschwindigkeiten der einzelnen Isotope zurückzuführen.
Nuklide vs. Isotope
Es gibt ein Begriff, der mit Isotopen zusammenhängt, aber etwas allgemeiner ist. Als Nuklid bezeichnet man eine Gruppe von Atomen, deren Kernstruktur streng durch die Anzahl der Protonen und Neutronen bestimmt ist. Dies bedeutet, dass zwei Nuklide, die sich in der Anzahl der Neutronen unterscheiden, Isotope sein können. In der Praxis sind alle Isotope Nuklide, aber nicht jedes Nuklid muss ein Isotop sein. Der Grundgedanke dieser beiden Begriffe sind die chemischen Eigenschaften bei Isotopen und die nuklearen Eigenschaften bei Nukliden. Zum Beispiel:
- Nuklide, die Isotope sind:
- Nuklide, die nicht gleichzeitig Isotope sind:
Isotope in der Natur
Die in der Natur vorkommenden chemischen Elemente sind Mischungen von Isotopen mit einer festen prozentualen Zusammensetzung. Je nach Kern kann die Zusammensetzung aus einem, mehreren oder sehr vielen Isotopen bestehen. Einige von ihnen sind stabil, andere wiederum unterliegen sehr schnellen Veränderungen. Ein solcher Zerfall kann zur Bildung von Isotopen desselben oder eines anderen Elements führen. Solche Übergänge gehen normalerweise mit der Emission von Strahlung einher. Anhand spezifischer Werte kann man sagen, dass es auf der Erde Elemente mit einer Ordnungszahl von 92 oder niedriger gibt, während Elemente mit einer Ordnungszahl bis 83 als stabil gelten. In der Natur gibt es 81 Elemente, die stabile Isotope haben. Dazu gehören Silizium mit den Isotopen 28Si, 29Si und 30Si, Eisen mit den Isotopen 54Fe, 56Fe, 57Fe und 58Fe sowie Aluminium mit nur einem stabilen Isotop, 27Al.
Isotope des Wasserstoffs
In der Natur kommen drei Isotope des Wasserstoffs vor, die ein Gemisch des Elements bilden. In der Praxis machen die Isotope 1H (Wasserstoff-1) und 2H (Wasserstoff-2) mit 99,985% bzw. 0,015% den größten Teil des gesamten Wasserstoffvorkommens aus. Das Isotop 3H (Wasserstoff-3) ist instabil und macht nur Spurenmengen aus. Wasserstoff-1 ist das bekannteste Protium, Wasserstoff-2, auch bekannt als Deuterium, besteht aus einem Proton und einem Neutron, und das letzte Isotop, Wasserstoff-3 oder Tritium, hat ein Proton und zwei Neutronen in seinem Kern. Daher ist der Massenunterschied zwischen den beiden sehr groß – das Deuterium-Atom hat die doppelte Masse des Protiums, und Tritium hat im Vergleich zum Protium sogar die dreifache Masse. Bekanntlich liegt Wasserstoff in jeder Isotopenform als zweiatomiges Molekül vor. Es hat sich herausgestellt, dass es auch Moleküle bilden kann, die verschiedene Isotope enthalten, nämlich die Typen HD (Protium-Deuterium), HT (Protium-Tritium) und DT (Deuterium-Tritium). Deuterium ist ein nicht-radioaktives Isotop mit hoher Stabilität. Er ist unter dem Namen schwerer Wasserstoff zu finden. Ersetzt man Wasserstoff-1 durch Deuterium im Wassermolekül (D2O), ändern sich seine Eigenschaften – der Schmelzpunkt steigt um etwa 1,5oC und der Gefrierpunkt um bis zu 3,81oC. Auch seine Dichte ist im Vergleich zu H2O um etwa 0,1% höher. Tritium hingegen ist ein sehr instabiles Isotop, das Radioaktivität aufweist. In seinem Kern kommt es zu spontanen radioaktiven Zerfällen, deren Ergebnis Heliumatome sind. Vergleicht man die physikalisch-chemischen Eigenschaften der Isotope, so lassen sich grundlegende Unterschiede feststellen, wie in Tabelle 1 dargestellt.
Tabelle 1. Vergleich der grundlegenden physikalisch-chemischen Parameter für Wasserstoffisotope.
| Isotop | Symbol | Dichte [g/l] | Schmelzpunkt [K] | Siedepunkt [K] |
| Protium | H | 0,08233 | 13,83 | 20,27 |
| Deuterium | D | 0,1645 | 18,73 | 23,67 |
| Tritium | T | 0,2464 | 20,62 | 25,04 |
Isotope des Kohlenstoffs
Das Element Kohlenstoff hat drei uns bekannte Isotope: 12C, 13C und 14C, und jedes von ihnen hat die gleichen chemischen Eigenschaften. Kohlenstoff-12 ist das häufigste und macht 98,89% aller Atome aus. Das Isotop 13C kommt auf der Erde in etwa 1,11% vor und das letzte, das Atom 14C, kommt einmal in etwa 1012 vor. Letzteres neigt zum spontanen Zerfall, was zur Emission von Betastrahlung führt. Es verwandelt sich dann in ein Stickstoffatom. Das stabile Isotop hingegen ist Kohlenstoff-13, das aufgrund seines von Null verschiedenen Spins in der magnetischen Kernresonanz 13 NMR verwendet werden kann.
Verwendung von Isotopen
In Rauchmeldern werden die nicht persistenten Isotope 241Am oder 238Pu verwendet, die sich durch einen langsamen Zerfall in Verbindung mit Strahlungsemission auszeichnen. Wenn Rauch aufsteigt, wird die Strahlung blockiert und erreicht den Melder nicht mehr, wodurch der Alarm ausgelöst wird. Da die Zerfallsstrahlung einiger Elemente in der Lage ist, Mikroorganismen zu zerstören, können Isotope wie 60Co zur Lebensmittelkonservierung verwendet werden. In der medizinischen Diagnostik werden einige Kerne verwendet, um Veränderungen in den zu untersuchenden Organen festzustellen, z.B. in den Nieren oder im Herzen. Ein solches Isotop wird mit einer biologisch inaktiven Substanz mit bekanntem Pfad im Körper verbunden und in den Blutkreislauf eingeführt. Auf diese Weise lässt sich der Weg der Strahlung verfolgen und ihre Akkumulation in Geweben und Organen beobachten. Die Strahlentherapie, die auf der Emission von Strahlung durch nicht beständige Isotope wie 226Ra und 60Co beruht, wird ebenfalls zur Behandlung von Krebs eingesetzt. Das Ziel einer solchen Therapie ist die Zerstörung von Krebszellen. Eines der Kohlenstoffisotope, 14C, wird zur Bestimmung des Alters von Materialien organischen Ursprungs verwendet. Dieser unbeständige Kern zerfällt langsam, und wenn der Organismus stirbt und die Kohlenstoffaufnahme eingestellt wird, nimmt die Kohlenstoff-14-Konzentration im Organismus proportional zu den vergangenen Jahren ab. Einige Isotope, z.B. 239Pu und 235U, werden in Kernkraftwerken verwendet. Beim Zerfall dieser unbeständigen Kerne entsteht Energie, die wiederum in Elektrizität umgewandelt werden kann.
Atommasse und Isotope
Die im Periodensystem angegebene Atommasse der Elemente ist eigentlich eine Durchschnittsmasse. Bei ihrer Berechnung werden die Anzahl (n) und die prozentuale Zusammensetzung (xn) der einzelnen Isotope eines Elements berücksichtigt, gemäß der Formel:
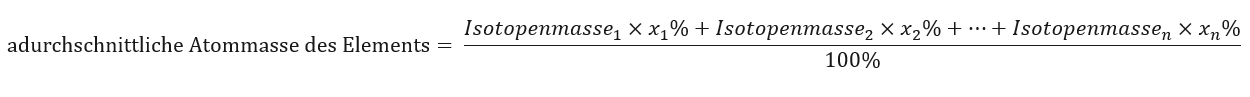
Berechnet man zum Beispiel die durchschnittliche Atommasse von Wasserstoff, so erhält man folgende Gleichung:

