Il termine “elemento” si riferisce agli atomi i cui nuclei contengono un determinato numero di protoni. Oltre a questi, un nucleo atomico è costituito anche da altre molecole: i neutroni. Il loro numero all'interno di un singolo elemento può variare. In tal caso si parla di isotopi, cioè di varianti di un dato elemento che hanno nel nucleo un diverso numero di neutroni. Pertanto, anche i loro numeri di massa sono diversi. Tuttavia, il numero atomico rimane costante, poiché il numero di elettroni sui gusci elettronici rimane invariato.

Per questo motivo gli isotopi di uno stesso elemento hanno la stessa posizione nella tavola periodica e ciascuno di essi ha la stessa dimensione. Inoltre, le loro proprietà chimiche e fisiche sono simili. Tuttavia, ci sono eccezioni in cui soprattutto le proprietà fisiche sono più diversificate, il che di solito si verifica quando si tratta di due isotopi con differenze significative di massa. Ciò è dovuto al fatto che è la massa a determinare tutta una serie di proprietà come la densità o la velocità di diffusione delle particelle. Al contrario, parametri come la conduttività elettrica o il colore non segnalato dalla massa. La diversità delle proprietà chimiche deriva normalmente da velocità disuguali di reazione di vari isotopi.
Nuclidi vs isotopi
C’è un concetto associato agli isotopi, che è più generico. Un nuclide è un intero insieme di atomi la cui struttura nucleare è specificatamente determinata dal numero di protoni e neutroni. Ciò significa che due nuclidi che differiscono nel numero di neutroni possono essere isotopi. In pratica, tutti gli isotopi sono nuclidi ma non tutti i nuclidi sono necessariamente isotopi. L’idea principale alla base di questi due concetti riguarda le proprietà chimiche nel caso degli isotopi e le proprietà nucleari nel caso dei nuclidi. Per esempio:
- Nuclidi che sono isotopi:
- Nuclidi che non sono isotopi:
Isotopi in natura
Gli elementi chimici esistenti nell’ambiente naturale sono una miscela di isotopi con una composizione percentuale costante. A seconda del nucleo, un elemento può contenere uno, più o più isotopi. Alcuni di loro sono stabili, ma altri si trasformano rapidamente. Tale decomposizione può produrre isotopi dello stesso o di un elemento diverso. Tali transizioni di solito vanno di pari passo con l’emissione di radiazioni. Per usare dei valori particolari, sulla Terra ci sono elementi i cui numeri atomici sono uguali o inferiori a 92. Quelli con numeri fino a 83 sono considerati stabili. Ci sono ben 81 elementi esistenti in natura che hanno isotopi stabili. Tra questi il silicio, con gli isotopi 28 Si, 29 Si e 30 Si, il ferro, con gli isotopi 54 Fe, 56 Fe, 57 Fe e 58 Fe, o l’alluminio, che ha un solo isotopo stabile: 27 Al.
Isotopi dell’idrogeno
In natura possiamo trovare tre isotopi di idrogeno che formano una miscela di elementi. In pratica, gli isotopi 1 H (idrogeno-1) e 2 H (idrogeno-2) rappresentano una maggioranza, rispettivamente, del 99,985%e dello 0,015 %della presenza totale di idrogeno. L’isotopo 3 H (idrogeno-3) è instabile e rappresenta solo alcune tracce. L’idrogeno-1 è il protio più conosciuto, l’idrogeno-2 (chiamato anche deuterio) è formato da un protone e un neutrone, mentre il nucleo dell’ultimo isotopo (idrogeno-3, cioè il trizio) contiene un protone e dovuto neutroni. Per questo motivo la differenza di massa tra questi isotopi è significativo: l’atomo di deuterio è due volte più pesante di quello del protio, mentre il trizio è addirittura tre volte più pesante del protio. Come sappiamo, l’idrogeno in qualsiasi forma isotopica esiste come molecola biatomica. Si scopre che può anche formare molecole contenenti diversi isotopi, cioè HD (protio-deuterio), HT (protio-trizio) e DT (deuterio-trizio). Il deuterio è un isotopo non radioattivo e ad alta stabilità. A volte è indicato come idrogeno pesante. Se sostituiamo l’idrogeno-1 con il deuterio in una molecola di acqua (D 2 O), la molecola cambierà le sue proprietà: il punto di fusione aumenterà di circa 1,5 o C e il punto di congelazione scenderà di ben 3, 81 o C. Anche la sua densità indicativa rispetto all’H 2 O di circa lo 0,1%. Al contrario, il trizio è un isotopo altamente instabile che è anche radioattivo. Il suo nucleo è un luogo di decomposizioni radioattive spontanee che producono atomi di elio. Se confrontiamo le proprietà fisico-chimiche degli isotopi, troveremo differenze essenziali, che sono mostrate nella Tabella 1. Tabella 1. Confronto dei parametri fisico-chimici di base degli isotopi dell’idrogeno.
| Isotopo | Simbolo | Densità [g /l] | Punto di fusione [K] | Punto di ebollizione [K] |
| Protio | H | 0.08233 | 13.83 | 20.27 |
| Deuterio | D | 0,1645 | 18.73 | 23.67 |
| Trizio | T | 0,2464 | 20.62 | 25.04 |
Isotopi del carbonio
Il carbonio ha tre isotopi noti: 12 C, 13 C e 14 C, ognuno dei quali ha le stesse proprietà chimiche. Il più comune è il carbonio-12, che rappresenta fino al 98,89 %di tutti gli atomi. L’isotopo 13 C esistente sulla Terra rappresenta circa l’1,11%, mentre l’atomo 14 C si trova in uno ogni circa 10 12 . Quest’ultimo è predisposto ad una decomposizione spontanea, che provoca l’emissione di radiazioni beta. Quindi l’isotopo si trasforma in un atomo di azoto. Un isotopo stabile è il carbonio-13. Grazie al suo spin diverso da zero, può essere applicato nella risonanza magnetica nucleare a 13 NMR.
Applicazione degli isotopi
Nei rilevatori di fumo utilizzati isotopi instabili, 241 Am o 238 Pu, rilevati da una lente di decomposizione unita all’emissione di radiazioni. Quando compare del fumo, la radiazione viene bloccata e non raggiunge più il rilevatore, attivando così l’allarme. La radiazione di decomposizione di alcuni elementi è in grado di distruggere i microrganismi, e quindi gli isotopi, compreso il 60 Co, possono essere utilizzati per conservare gli alimenti. Nella diagnostica medica, alcuni nuclei vengono utilizzati per rilevare i cambiamenti negli organi testati, ad esempio nei reni o nel cuore. Tale isotopo si combina con una sostanza biologicamente inattiva con un percorso noto nel corpo e lo introduce nel sistema di circolazione sanguigna. Ciò consente di tracciare il percorso della radiazione e osservare come si accumula nei tessuti e negli organi. Nel trattamento del tumore, applichiamo anche la radioterapia basata sull’emissione di radiazioni da parte di isotopi instabili come 226 Ra e 60 Co. L’obiettivo di tale terapia è distruggere le cellule tumorali. Uno degli isotopi del carbonio, 14 C, viene utilizzato per determinare l’età dei materiali di origine organica. Questo nucleo instabile si decompone lentamente e se l’organismo muore (che è quando cessa l’assimilazione del carbonio), la sua concentrazione di carbonio-14 si riduce in proporzione al passare degli anni. Alcuni isotopi, ad esempio 239 Pu e 235 U, sono utilizzati nelle centrali nucleari. Durante la decomposizione di questi nuclei instabili, viene prodotta energia che a sua volta può essere convertita in elettricità.
Massa atomica e isotopi
La massa atomica degli elementi presentati nella tavola periodica è in realtà la massa media. Quando lo calcoliamo, prendiamo in considerazione il numero (n) e la composizione in percentuale (x n ) di ciascun isotopo dell’elemento in questione, secondo la seguente formula: 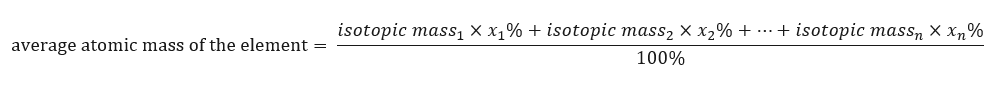 Ad esempio, calcolando la massa atomica media dell’idrogeno, otterremo la seguente equazione:
Ad esempio, calcolando la massa atomica media dell’idrogeno, otterremo la seguente equazione: 

