Termen "element" hänvisar till atomer vars kärnor innehåller ett visst antal protoner. Förutom att de består en atomkärna också av andra molekyler: neutroner. Deras antal inom ett enda element kan variera. I ett sådant fall talar vi om isotoper, alltså varianter av ett givet grundämne som har olika antal neutroner i sin kärna. Sålunda är deras massatal också olika. Atomnumret förblir dock konstant, eftersom antalet elektroner på elektronskal förblir oförändrat.

Av denna anledning har isotoper av samma element samma position i det periodiska systemet, och var och en av dem har samma storlek. Deras kemiska och fysikaliska egenskaper är också liknande. Det finns dock undantag där speciella fysikaliska egenskaper är mer diversifierade, vilket allmänt uppstår när vi har gjort med två isotoper med skillnader i massa. Detta beror på att det är massan som bestämmer en hel rad egenskaper som densitet eller partikeldiffusionshastighet. Parametrar som elektrisk ledningsförmåga eller färg beror dock inte på massan. Mångfalden av kemiska egenskaper kommer normalt från olika reaktionshastigheter för olika isotoper.
Nuklider vs isotoper
Det finns ett koncept för knippat med isotoper, som är mer generiskt. En nuklid är en hel uppsättning atomer vars kärnstruktur bestäms specifikt av antalet protoner och neutroner. Det betyder att två nuklider som skiljer sig åt i antal neutroner kan vara isotoper. Jag praktiken är alla isotoper nuklider men inte varje nuklid är nödvändigtvis en isotop. Huvudtanken bakom dessa två begrepp omfattar kemiska egenskaper när det gäller isotoper och nukleära egenskaper när det gäller nuklider. Till exempel:
- Nuklider som är isotoper:
- Nuklider som inte är isotoper:
Isotoper i naturen
Kemiska grundämnen som finns i den naturliga miljön är en blandning av isotoper med en konstant procentuell sammansättning. Beroende på kärnan kan ett grundämne innehålla en, flera eller flera isotoper. Vissa av dem är stabila, men vissa förvandlas snabbt. En sådan nedbrytning kan producera isotoper av samma eller ett annat grundämne. Sådana övergångar går tillsammans med utsläpp av strålning. För att använda särskilda värden, på jorden finns det element vars atomnummer är lika med eller lägre än 92. De med nummer upp till 83 anses vara stabila. Det finns så många som 81 naturligt existerande grundämnen som har stabila isotoper. Dessa inkluderar kisel, med isotoper 28 Si, 29 Si och 30 Si, järn, med isotoper 54 Fe, 56 Fe, 57 Fe och 58 Fe, eller aluminium, som bara har en stabil isotop: 27 Al.
Väteisotoper
I naturen kan vi hitta tre väteisotoper som bildar en grundämnesblandning. I praktiken representerar isotoperna 1 H (väte-1) och 2 H (väte-2) en majoritet av 99,985 %respektive 0,015 %av den totala förekomsten av väte. Isotopen 3H (väte- 3 ) är instabil och representerar endast några spårmängder. Väte-1 är det mest kända protiumet, väte-2 (även kallat deuterium) består av en proton och en neutron, medan kärnan i den sista isotopen (väte-3, dvs tritium) innehåller en proton och två neutroner. Av denna anledning är skillnaden i massan mellan dessa isotoper producerar: deuteriumatomen är dubbelt så tung som protiums, medan tritium är till och med tre gånger tyngre än protium. Som vi vet existerar väte i vilken isotopform som helst som en diatomisk molekyl. Det visar sig att det även kan bilda molekyler som innehåller olika isotoper, dvs HD (protium-deuterium), HT (protium-tritium) och DT (deuterium-tritium). Deuterium är en icke-radioaktiv, högstabil isotop. Det kallas ibland tungt väte. Om vi ersätter väte-1 med deuterium i en vattenmolekyl (D 2 O) kommer molekylen att ändra sina egenskaper: smältpunkten kommer att stiga med cirka 1,5 o C och fryspunkten sjunker med så många som 3,81 o C. Dess densitet kommer också att öka i förhållande till H 2 O med cirka 0,1 %. Däremot är tritium och mycket instabil isotop som också är radioaktivt. Dess kärna är en plats för spontana radioaktiva sönderdelningar som producerar heliumatomer. Om vi jämför de fysikalisk-kemiska egenskaperna hos isotoper hittar vi väsentliga skillnader, vilka visa i Tabell 1. Tabell 1. Jämförelse av grundläggande fysikalisk-kemiska parametrar för väteisotoper.
| Isotop | Symbol | Densitet [g /l] | Smältpunkt [K] | Kokpunkt [K] |
| Protium | H | 0,08233 | 13,83 | 20.27 |
| Deuterium | D | 0,1645 | 18,73 | 23,67 |
| Tritium | T | 0,2464 | 20,62 | 25.04 |
Kolisotoper
Kol har tre kända isotoper: 12 C, 13 C och 14 C, var och en av dem har samma kemiska egenskaper. Den vanligaste är kol-12, som representerar så mycket som 98,89 %av alla atomer. Den 13 C-isotop som finns på jorden representerar cirka 1,11 %, medan 14 C-atomen förekommer i en per cirka 10 12 . Den senare är predisponerad för en spontan nedbrytning, vilket orsakar utsläpp av betastrålning. Sedan omvandlas isotopen till en kväveatom. En stabil isotop är kol-13. På grund av dess spinn som inte är noll kan den appliceras i 13 NMR kärnmagnetisk resonans.
Tillämpning av isotoper
I rökdetektorer använder vi instabila isotoper, 241 Am eller 238 Pu, som kännetecknas av en långsam nedbrytning i kombination med utsläpp av strålning. När rök dyker upp blockeras strålningen och när inte längre detektorn, vilket utlöser larmet. Nedbrytningsstrålningen av vissa grundämnen kan förstöra mikroorganismer, och därför kan isotoper, inklusive 60 Co, användas för att konservera mat. Inom medicinsk diagnostik används vissa kärnor för att upptäcka förändringar i de testade organen, till exempel i njurar eller i hjärtat. En sådan isotop kombineras med en biologiskt inaktiv substans med en känd väg i kroppen och introducerar i blodcirkulationssystemet. Detta gör det möjligt att spåra strålningens väg och observera när den ackumuleras i vävnader och organ. Vid tumörbehandling tillämpar vi även strålbehandling baserad på strålning från instabila isotoper som 226 Ra och 60 Co. Målet med en sådan terapi är att förstöra tumörceller. En av kolisotoperna, 14 C, används för att analysera åldern på material av organiskt ursprung. Denna instabila kärna sönderdelas långsamt, och om organismen dör (vilket är när assimileringen av kol upphör), minskar dess koncentration av kol-14 i proportion till de år som går. Vissa isotoper, till exempel 239 Pu och 235 U, används i kärnkraftverk. Vid nedbrytningen av dessa instabila kärnor produceras energi som i sin tur kan omvandlas till elektricitet.
Atommassa och isotoper
Atommassan för grundämnen som presenteras i det periodiska systemet är faktiskt den genomsnittliga massan. När vi beräknar det tar vi hänsyn till antalet (n) och den procentuella sammansättningen (x n ) av varje isotop av elementet i fråga, enligt följande formel: 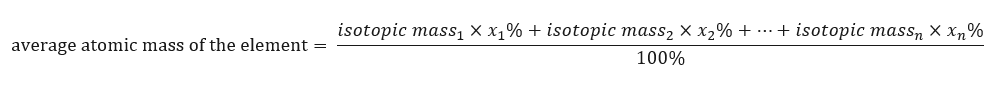 Till exempel, när vi beräknar den genomsnittliga atommassan av väte, får vi följande ekvation:
Till exempel, när vi beräknar den genomsnittliga atommassan av väte, får vi följande ekvation: 

