Pojem „prvok“ sa vzťahuje na atómy, ktorých jadrá obsahujú určitý počet protonov. Okrem nich sa atómové jadro skladá aj z ďalších molekúl: neutrónov. Ich počet v rámci jedného prvku sa môže líšiť. V takomto prípade hovoríme o izotopoch, teda variantoch daného prvku, ktoré majú v jadre rôzny počet neutrónov. Ich hmotnostné čísla sú teda tiež odlišné. Atómové číslo však zostáva konštantné, pretože počet elektrónov na elektrónových obaloch zostáva nezmenený.

Z tohto dôvodu majú rovnakú porciu v periodickej tabuľke a každý z nich má rovnakú veľkosť. Tiež ich chemické a fyzikálne vlastnosti sú podobné. Výnimky, kde sú najmä fyzikálne vlastnosti diverzifikovanejšie, čo sa najčastejšie vyskytuje, aj keď existujú výrazné rozdiely v hmotnosti. Je to tým, že práve určuje hmotnosť celý rad vlastností ako hustota či rýchlosť difúzie častíc. Naproti tomu parametre ako elektrická vodivosť alebo farba nezávisia od hmotnosti. Rozmanitosť chemických vlastností zvyčajne pochádza z nerovnakej rýchlosti reakcie rôznych izotopov.
Nuklidy vs izotopy
Existuje spojený s izotopmi, ktorý je pojem všeobecnejší. Nuklid je celý súbor atómov, ktorých štruktúra je špecificky určená počtom protónov a neutrónov. To znamená, že dva nuklidy, ktoré sa nachádzajú počtom neutrónov, môžu byť izotopy. V praxi sú izotopy nuklidmi, ale nie každý nuklid je zapnutý izotopom. Hlavná myšlienka týchto dvoch konceptov zahŕňa chemické vlastnosti v prípade izotopov a jadrové vlastnosti v prípade nuklidov. Napríklad:
- Nuklidy, ktoré sú izotopmi:
- Nuklidy, ktoré nie sú izotopmi:
Izotopia v prírode
Chemické prvky existujúce v prírodnom prostredí sú zmesou izotopov s konštantným bežným zložením. V závislosti od jadra môže prvok obsahovať jeden, niekoľko alebo viac izotopov. Niektoré z nich sú stabilné, ale niektoré sa rýchlo transformujú. Takýmto rozkladom môžu vzniknúť izotopy rovnakého alebo odlišného prvku. prechodne bežne sprevádzajú emisie žiarenia. Aby sme použili konkrétne hodnoty, na Zemi existujú prvky, ktorých atómové čísla sú rovné alebo nižšie ako 92. Tie s číslami do 83 sa považujú za stabilné. Existuje až 81 prirodzene známych prvkov, ktoré majú stabilné izotopy. Patria sem kremík s izotopmi 28 Si, 29 Si a 30 Si, železo s izotopmi 54 Fe, 56 Fe, 57 Fe a 58 Fe alebo hliník, ktorý má len jeden stabilný izotop: 27 Al.
Izotopy vodíka
V prírode môžeme nájsť tri izotopy vodíka, ktoré tvoria zmes prvkov. V praxi predstavujú izotopy 1H (vodík-1) a 2H (vodík-2) 99,985 %a 0,015 %z celkového výskytu vodíka. Izotop 3H (vodík-3) je nestabilný a predstavuje len niektoré stopové množstvá. Vodík-1 je najznámejšie protium, vodík-2 (nazývaný aj deutérium) je vyrobený z jedného protónu a jedného neutrónu, pričom jadro posledného izotopu (vodík-3, teda trícium) obsahuje jeden protón a dva neutróny. Z tohto dôvodu je rozdiel v hmotnosti medzi týmito izotopmi významný: atóm deutéria je dvakrát tak ťažký ako atóm protia, zatiaľ čo je trikrát ťažké ako protium. Ako vieme, vodík v izotopovej forme existuje ako dvojatómová molekula. Ukazuje sa, že môže tvoriť aj molekuly obsahujúce rôzne izotopy, tj HD (protium-deutérium), HT (protium-trícium) a DT (deutérium-trícium). Deutérium je nerádioaktívny izotop s vysokou stabilitou. Niekedy sa označuje ako ťažký vodík. Ak v molekule vody (D 2 O) nahradíme vodík-1 deutériom, molekula zmení svoje vlastnosti: teplota topenia stúpne asi o 1,5 ° C a teplota tuhnutia klesne až o 3,81 ° C. Jeho hustota sa tiež zvýši v porovnaní s H20 približne 0,1 %. Naproti tomu trícium je vysoko nestabilný izotop, ktorý je tiež rádioaktívny. Jeho je jadro spontánnych rádioaktívnych rozkladov, pri ktorých vznikajú atómy hélia. Ak porovnáme fyzikálno-chemické vlastnosti izotopov, zistíme podstatné rozdiely, ktoré sú uvedené v tabuľke 1. Tabuľka 1. Porovnanie základných fyzikálno-chemických parametrov izotopov vodíka.
| izotop | Symbol | Hustota [g /l] | Teplota topenia [K] | Bod varu [K] |
| Protium | H | 0,08233 | 13,83 | 20.27 |
| deutérium | D | 0,1645 | 18,73 | 23,67 |
| Trícium | T | 0,2464 | 20,62 | 25.04 |
Izotopy uhlíka
Uhlík má tri známe izotopy: 12C , 13C a 14C , pričom každý z nich má rovnaké chemické vlastnosti. Najbežnejší je uhlík-12, ktorý predstavuje až 98,89 %všetkých atómov. Izotop 13C existujúci na Zemi predstavuje približne 1,11 %, zatiaľ čo atóm 14C sa vyskytuje v jednom z približne 10 12 . Ten je predisponovaný k spontánnemu rozkladu, ktorý spôsobuje emisie beta žiarenia. Potom sa izotop premeny na atóm dusíka. Stabilný izotop je uhlík-13. Vďaka svojmu nenulovému spinu ho možno použiť pri 13 NMR nukleárnej magnetickej rezonancii.
Aplikácia izotopov
V detektoroch dymu používame nestabilné izotopy 241 Am alebo 238 Pu, ktoré sa pomaly rozkladajú a sú spojené s emisiou žiarenia. Keď sa objaví dym, žiarenie sa zablokuje a už sa nedostane k detektoru, čím sa spustí poplach. Rozkladné žiarenie niektorých prvkov je schopné ničiť mikroorganizmy, a preto sa na konzervovanie potravín môže použiť izotopy vrátane 60Co . V lekárskej diagnostike sa pomocou určitých jadier zisťujú zmeny v testovaných orgánoch, napríklad v obličkách alebo v srdci. Takýto izotop sa spája s biologicky neaktívnou látkou, ktorá je zavedená tak známou cestou v tele a do systému krvného obehu. Umožňuje sledovať cestu žiarenia a pozorovať, ako sa hromadí v tkanivách a orgánoch. V liečbe nádorov aplikujeme aj rádioterapiu založenú na emisii žiarenia 2 nestabilnými izotopmi ako 226 Ra a 60 Co. Cieľom takejto terapie je ničenie nádorových buniek. Jeden z izotopov uhlíka, 14C , sa používa na testovanie veku materiálov organického pôvodu. Toto nestabilné jadro sa pomaly rozkladá a ak organizmus odumrie (vtedy sa zastaví asimilácia uhlíka), jeho koncentrácia uhlíka-14 sa úmerne s pribúdajúcimi rokmi znižuje. Niektoré izotopy, napríklad 239 Pu a 235 U, sa používajú v jadrových elektrárňach. Počas rozkladu týchto nestabilných jadier sa vyrába energia, ktorá sa môže premeniť na elektrinu.
Atómová hmotnosť a izotopy
Atómová hmotnosť prvkov uvedené v periodickej tabuľke je v priemernej hmotnosti. Pri jej výpočte berieme do úvahy počet (n) príslušné príslušné zloženie (x n ) každého izotopu prvku podľa nasledujúceho vzorca: 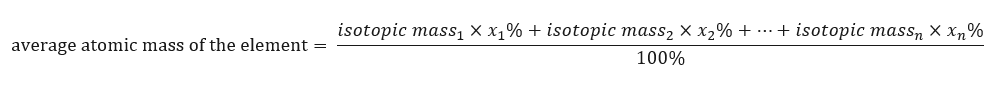 Napríklad pri výpočte priemernej atómovej hmotnosti vodíka dostaneme nasledujúce rovnice:
Napríklad pri výpočte priemernej atómovej hmotnosti vodíka dostaneme nasledujúce rovnice: 

