De term "element" verwijst naar atomen waarvan de kernen een bepaald aantal protonen bevatten. Naast deze een atoomkern bestaat er ook een andere: neutronen. Hun aantal binnen een enkel element kan variëren. In zo'n geval spreken we van isotopen, dwz varianten van een bepaald element die verschillende verzamelde neutronen in hun kern hebben. Hun massagetallen zijn dus ook verschillend. Het atoomnummer blijft echter constant, het aantal oplossingen blijft verborgen.

Om deze reden hebben de isotopen van hetzelfde element dezelfde positie in het periodieke systeem en hebben ze allemaal dezelfde grootte. Ook zijn hun chemische en fysische eigenschappen vergelijkbaar. Er zijn echter uitzonderingen waarbij vooral de fysische eigenschappen meer gediversifieerd zijn, wat zelden gebeurt wanneer we te maken hebben met twee isotopen met significante verschillen in massa. Dit komt mede door het de massa is die een hele reeks eigenschappen bepaald, zoals dichtheid of diffusiesnelheid van deeltjes. Daarentegen zijn parameters zoals elektrische geleidbaarheid of kleur niet afhankelijk van massa. De diversiteit aan chemische eigenschappen komt normaal gesproken voort uit ongelijke reactiesnelheden van verschillende isotopen.
Nucliden versus isotopen
Er is een concept geassocieerd met isotopen, dat algemeener is. Een nuclide is een hele reeks atomen waarvan de nucleaire structuur specifiek wordt bepaald door het aantal protonen en neutronen. Dit betekent dat twee nucliden verschillen in het aantal neutronen, isotopen kunnen zijn. In de praktijk zijn alle isotopen nucliden, maar niet elke nuclide is geen isotoop. Het hoofdidee achter deze twee concepten omvat chemische eigenschappen in het geval van isotopen en nucleaire eigenschappen in het geval van nucliden. Bijvoorbeeld:
- Nucliden die isotopen zijn:
- Nucliden die geen isotopen zijn:
Isotopen in de natuur
Chemische elementen die in de natuurlijke omgeving voorkomen, zijn een mengsel van isotopen met een constante procentuele samenstelling. zekerheid van de kern kan een element één, meerdere of meer isoopen omvatten. Van hen zijn stabiel, maar sommige transformeren snel. Zo’n ontleding kan isotopen produceren van hetzelfde van een ander element. tussentijden overgang gaan gedeeltelijk samen met de uitzending van straling. Om bepaalde waarden te gebruiken: op aarde zijn er elementen waarvan de atoomnummers gelijk zijn aan of lager zijn dan 92. Die met nummers tot 83 kunnen als stabiel worden beschouwd. Er zijn maar liefst 81 natuurlijk bestaande elementen die isotopen hebben. Denk aan silicium, met isotopen 28 Si, 29 Si en 30 Si, ijzer, met isotoop 54 Fe, 56 Fe, 57 Fe en 58 Fe, van aluminium, dat maar één stabiele isotoop heeft: 27 Al.
Waterstof isoopen
In de natuur kunnen we drie waterstofisotopen vinden die een elementenmengsel vormen. In de praktijkvertegenwoordigers van isotopen 1H (waterstof-1) en 2H (waterstof-2) een meerderheid van onbewuste 99,985%en 0,015%van het totaal voorkomen van waterstof. De isotoop 3 H (waterstof-3) is onstabiel en slechts enkele sporen vertegenwoordigd. Waterstof-1 is het bekendste protium, waterstof-2 (ook wel deuterium genoemd) is gemaakt van één proton en één neutron, terwijl de kern van de laatste isotoop (waterstof-3, oftewel tritium) één proton en twee neutronen bevat. Om deze reden is het verschil in massa tussen deze isotopen significant: het atoom van deuterium is twee keer zo zwaar als dat van protium, terwijl tritium zelfs drie keer zo zwaar is als protium. Zoals we weten, bestaat waterstof in elke isotopische vorm als een diatomisch molecuul. Het heeft aangetoond dat het ook mogelijke vormen van verschillende isotopen kan zijn, namelijk HD (protium-deuterium), HT (protium-tritium) en DT (deuterium-tritium). Deuterium is een niet-radioactieve, zeer stabiele isotoop. Het wordt ook wel zware waterstof genoemd. Als we waterstof-1 vervangen door deuterium in een molecuul water (D 2 O), verandert het molecuul van eigenschappen: het smeltpunt stijgt met ongeveer 1,5 o C en het vriespunt vermindert met maar liefst 3,81 o C. De verandering zal ook ongeveer tien procent van H 2 O met ongeveer 0,1%. Tritium-overdracht is een zeer onstabiele isotoop die ook radioactief is. De kern is een plaats van spontane radioactieve ontbindingen die heliumatomen produceren. Als we de fysisch-chemische eigenschappen van isotopen vergelijken, vinden we fundamentele verschillen, die worden weergegeven in tabel 1. Tabel 1. Vergelijking van onderliggende fysisch-chemische parameters van waterstofisotopen.
| Isotoop | Symbool | Dichtheid [g /l] | Smeltpunt [K] | Kookpunt [K] |
| Protium | H | 0,08233 | 13.83 | 20.27 |
| deuterium | D | 0,1645 | 18.73 | 23.67 |
| Tritium | T | 0,2464 | 20.62 | 25.04 |
Koolstof isoopen
Koolstof heeft drie bekende isotopen: 12 C, 13 C en 14 C, elk met dezelfde chemische eigenschappen. De meest waarschijnlijke is koolstof-12, dat maar liefst 98,89%van alle atomen vertegenwoordigt. De 13 C-isotoop die op aarde bestaat, vertegenwoordigt ongeveer 1,11%, terwijl de 14 C-atoom in één op de ongeveer 10 12 verdwijnt. De laatste is vatbaar voor spontane ontbinding, wat de emissie van bètastraling veroorzaakt. Vervolgens verandert de isotoop in een stikstofatoom. Een stabiele isotoop is koolstof-13. verklaring zijn niet-nul spin kan worden toegepast in 13 NMR nucleaire magnetische resonantie.
Toepassing van isotopen
In rookmelders gebruiken we instabiele isoopen, 241 Am of 238 Pu, die worden veroorzaakt door een langzame ontbinding in combinatie met de uitzendingen van straling. Als er rook verschijnt, wordt de straling geblokkeerd en bereikt deze de detector niet meer, waardoor het alarm afgaat. De ontledingsstraling van sommige elementen is in staat micro-organismen te vernietigen, en daarom kunnen isotopen, waaronder 60 Co, worden gebruikt voor het conserveren van voedsel. In de diagnostiek kunnen bepaalde kernen worden gebruikt om veranderingen in de medisch geteste organen te bepalen, bijvoorbeeld in de nieren of in het hart. Zo’n isotoop bestaat uit een biologisch inactieve stof met een bekende weg in het lichaam en brengt deze in de bloedsomloop. Dit maakt het mogelijk om het pad van de straling te volgen en te observeren hoe het zich ophoopt in weefsels en organen. Bij de behandeling van tumoren passen we ook radiotherapie toe op basis van stralingsemissie door instabiele isotopen zoals 226Ra en 60Co . Het doel van zo’n therapie is het vernietigen van tumorcellen. Een van de koolstofisotopen, 14 C, wordt toegepast voor het bepalen van de ouderdom van materialen van organische oorsprong. Deze onstabiele kern ontbindt langzaam, en als het organisme sterft (dat is wanneer de assimilatie van koolstof stopt), wordt de concentratie van koolstof-14 in relatie tot de voorbijgaande jaren. Sommige isoopen, bijvoorbeeld 239 Pu en 235 U, worden gebruikt in kerncentrales. Bij de ontbinding van de onstabiele kernen wordt energie geproduceerd die op haar beurt kan worden uitgeschakeld in elektriciteit.
Atoommassa en isotopen
De atoommassa van elementen die in het periodieke systeem wordt uitgezonden, is eigenlijk de gemiddelde massa. Bij de berekening houden we rekening met het aantal (n) en de procentuele samenstelling (x n ) van elke isotoop van het element in kwestie, volgens de volgende formule: 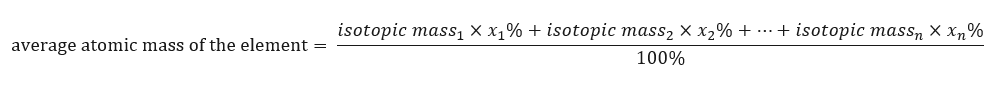 Bij het berekenen van de gemiddelde atoommassa van waterstof krijgen we bijvoorbeeld de volgende vergelijking:
Bij het berekenen van de gemiddelde atoommassa van waterstof krijgen we bijvoorbeeld de volgende vergelijking: 

