Termín "prvek" se týká atomů, jádra obsahují určitý počet protonů. Kromě nich se atomové jádro skládá také z dalších molekul: neutronů. Jejich počet v rámci jednoho prvku se může domnívat. V takovém případě hovoříme o izotopech, tedy variantách daného prvku, které mají v jádře různý počet neutronů. Jejich hmotnostní čísla jsou tedy také různá. Atomové číslo však zůstává, protože počet elektronů na elektronových obalech zůstává nezměněn.

Z tohoto důvodu mají izotopy stejné stejné pozice v periodické tabulce a každý z nich má stejnou velikost. Také jejich chemické a fyzikální vlastnosti jsou podobné. Existují však výjimky, kdy jsou zejména fyzikální vlastnosti diverzifikovanější, k čemuž obvykle dochází, když se zabýváme výrazně výraznými rozdíly v hmotnosti. Je to dáno tím, že právě hmotnost určuje vlastnosti jako je hustota nebo celou řadu difúze částic. Naproti tomu parametry jako elektrická vodivost nebo barva nezávisí na hmotnosti. Rozmanitost chemických vlastností obvykle pochází z nestejných rychlostí reakce různých izotopů.
Nuklidy vs izotopie
Existuje spojený s izotopy, který je pojem obecnější. Nuklid je celá sada atomů, jaderná struktura je specificky určena počtem protonů a neutronů. To znamená, že dva nuklidy, které se liší počtem neutronů, mohou být izotopy. V praxi jsou všechny izotopy nuklidy, ale ne každý nuklid je nutně izotop. Hlavní myšlenka těchto dvou konceptů pokrývá chemické vlastnosti v případě izotopů a jaderné vlastnosti v případě nuklidů. Například:
- Nuklidy, které jsou izotopy:
- Nuklidy, které nejsou izotopy:
Izotopie v přírodě
Chemické prvky existující v přírodním prostředí jsou směsí izotopů s obsahem procentuálním složením. V závislosti na jádře může prvek obsahovat jeden, několik nebo více izotopů. Některé z nich jsou stabilní, ale některé se rychle transformují. Takový může produkovat izotopy rozkladu stejného nebo odlišného prvku. Takové přechody obvykle probíhají spolu s emisemi. Abychom použili konkrétní hodnoty, na Zemi existují prvky, například atomová čísla jsou stejná nebo nižší než 92. Ty s čísla do 83 jsou považovány za stabilní. Existuje až 81 přirozeně existujících prvků, které mají stabilní izotopy. Patří mezi ně křemík s izotopy 28 Si, 29 Si a 30 Si, železo s izotopy 54 Fe, 56 Fe, 57 Fe a 58 Fe nebo hliník, který má pouze jeden stabilní izotop: 27 Al.
Izotopie vodíku
V přírodě můžeme najít tři izotopy vodíku, které tvoří směs prvků. V praxi představují izotopy 1H (vodík- 1 ) a 2H (vodík-2) většinu 99,985 %a 0,015 %celkového výskytu vodíku. Izotop 3H (vodík-3) je nestabilní a představuje pouze některá stopová množství. Vodík-1 je nejznámější protium, vodík-2 (nazývaný také deuterium) je tvořen jedním protonem a jedním neutronem, zatímco jádro posledního izotopu (vodík-3, tedy tritium) obsahuje jeden proton a dva neutrony. Z tohoto důvodu je rozdíl v hmotnosti mezi těmito izotopy významný: atom deuteria je dvakrát těžší než atom protium, zatímco tritium je dokonce třikrát těžší než protium. Jak víme, vodík v jakékoli izotopové formě existuje jako dvouatomová molekula. Ukazuje se, že může také tvořit molekuly obsahující různé izotopy, tj. HD (protium-deuterium), HT (protium-tritium) a DT (deuterium-tritium). Deuterium je neradioaktivní, vysoce stabilní izotop. Někdy je označován jako těžký vodík. Pokud v molekule vody (D 2 O) nahradíme vodík-1 deuteriem, molekula změní své vlastnosti: teplota se zvýší asi o 1,5 ° C a teplota klesne až o 3,81 ° C. Jeho hustota se také zvýší v poměru k H20 asi o 0,1 %. Naproti tomu tritium je vysoce nestabilní izotop, který je také radioaktivní. Jeho jádro je místem spontánních radioaktivních rozkladů, které produkují atomy helia. Porovnáme-li fyzikálně-chemické vlastnosti izotopů, najdeme podstatné rozdíly, které jsou uvedeny v tabulce 1. Tabulka 1. Porovnání základních fyzikálně-chemických parametrů izotopů vodíku.
| Izotop | Symbol | Hustota [g /l] | Bod tání [K] | Bod varu [K] |
| Protium | H | 0,08233 | 13,83 | 20.27 |
| Deuterium | D | 0,1645 | 18,73 | 23,67 |
| tritium | T | 0,2464 | 20,62 | 25.04 |
Izotopie uhlíku
Uhlík má tři známé izotopy: 12C , 13C a 14C , přičemž každý z nich má stejné chemické vlastnosti. Nejběžnější je uhlík-12, který představuje až 98,89 %všech atomů. Izotop 13C existující na Zemi představuje asi 1,11 %, zatímco atom 14C se vyskytuje v jednom na asi 10 12 . Ten je náchylný ke spontánnímu rozkladu, který využívá beta záření. Poté se izotop přemění na atom dusíku. Stabilní izotop je uhlík-13. Díky svému nenulovému spinu může být aplikováno v 13 NMR nukleární magnetické rezonanci.
Aplikace izotopů
V detektorech kouře používáme nestabilní izotopy 241 Am nebo 238 Pu, které se vyznačují pomalým rozkladem spojeným s emisemi záření. Jakmile se objeví kouř, záření se zablokuje a již nedosáhne detektoru, čímž se spustí poplach. Rozkladné záření některých prvků je schopné ničit mikroorganismy, a proto lze pro konzervaci potravin použít izotopy včetně 60Co . V lékařské diagnostice se některá jádra používají k detekci změn v testovaných orgánech, například v ledvinách nebo v srdci. Takový izotop se spojí s biologicky aktivní látkou se známou cestou v těle a zapadá do systému krevního oběhu. To umožňuje sledovat dráhu záření a pozorovat, jak se hromadí v tkáních a orgánech. V léčbě nádorů také aplikujeme radioterapii založeno na emisi záření nestabilními izotopy jako 226 Ra a 60 Co. Cílem takové terapie je zničit nádorové buňky. Jeden z izotopů uhlíku, 14C , se používá pro stanovení stáří materiálů organického původu. Toto nestabilní jádro se pomalu rozkládá, a pokud organismus zemře (což je okamžik, kdy se zastaví asimilace uhlíku), jeho koncentrace uhlíku-14 se úměrně s ubíhajícími roky snižuje. Některé izotopy, například 239 Pu a 235 U, se používají v jaderných elektrárnách. Během těchto nestabilních jader se vyrábí energie, která se zase může přeměnit na elektřinu.
Atomová hmotnost a izotopy
Atomová hmotnost prvků uvedených v periodické tabulce je ve skutečnosti průměrná hmotnost. Při jeho výpočtu bereme v úvahu počet (n) a procentuální složení (x n ) každého izotopu příslušného prvku podle následujícího vzorce: 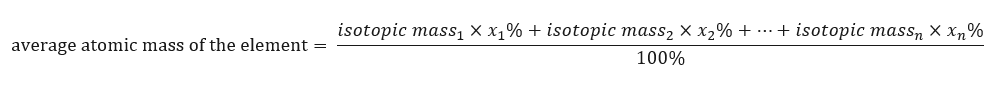 Například při výpočtu průměrné atomové hmotnosti vodíku získáme následující rovnici:
Například při výpočtu průměrné atomové hmotnosti vodíku získáme následující rovnici: 

