El fenómeno de la radiactividad (o emisión radiactiva) se observó por primera vez durante el experimento de Henri Becquerel sobre rayos X (radiación Roentgen) en 1896. Su experimento fue para confirmar la tesis sobre los materiales hechos de uranio, según la cual se suponía que emitía rayos X. rayos después de absorber la luz del sol.

Para realizar la prueba, se utilizó una película fotográfica, que se ennegreció bajo la influencia de estos rayos. El experimento ha demostrado que la radiación solar no es necesaria para que el material de prueba ennegrezca la película. Sin embargo, esto contradecía la hipótesis inicial, por lo que se tuvo que realizar más investigación. Esta vez, la tarea era confirmar o negar que los rayos X fueran el factor causante del cambio en la película. Se aprovechó el hecho de que los rayos X no llevan ninguna carga, por lo que no son desviados por el campo magnético. Becquerel colocó un material que contenía uranio y la película fotográfica en una cámara de vacío ubicada en un campo magnético. Como resultado del experimento, se descubrió que los rayos emitidos por la muestra analizada se doblan en el campo magnético, lo que significaba que no era lo mismo que los rayos X. En el curso de su investigación, el científico demostró que hay tres tipos de radiación que pueden emitir los materiales: neutra, cargada positivamente y cargada negativamente. Sobre la base de estas suposiciones, los investigadores posteriores presentaron sus tesis y realizaron más experimentos. Maria Skłodowska Curie y Pierre Curie descubrieron los siguientes elementos radiactivos: el polonio y el radio. Ernest Rutherford, premio Nobel de química , también dedicó una parte de su carrera a la radiactividad y nombró los tipos de radiación descubiertos por Becquerel con las letras griegas del alfabeto: alfa, beta y gamma.
Las investigaciones han demostrado que la radiactividad es una característica de algunos elementos. Esto indica su estrecha relación con su nivel atómico y, más específicamente, con el núcleo atómico. Cada uno de los tres tipos de radiación es un cuanto de energía que puede emitir un núcleo inestable. Esto significa que la radiación es en realidad el resultado de su descomposición. En la práctica, la aparición de estos núcleos inestables se debe a su proporción de protones a neutrones. Debido a los diferentes tipos de inestabilidad, también existen diferentes tipos de radiación. La clave para comprender la radiactividad son los isótopos y sus diferencias a nivel atómico. Por ejemplo, el isótopo de carbono más común, el 12 C, no es radiactivo, mientras que el 14 C sí lo es. Su número atómico , y por tanto el número de protones, es el mismo. La diferencia tampoco puede deberse al número de electrones, porque el átomo sería entonces un ion con carga positiva o negativa. La única posibilidad, en el caso de los isótopos, son las diferencias en el número de neutrones en el núcleo. El 14 C tiene dos neutrones más que el 12 C, por lo que también es más pesado. La existencia de isótopos para todos los elementos significa que el número de núcleos radiactivos también es grande. Estos isótopos inestables y radiactivos se denominan radioisótopos, pero su prevalencia no es tan alta como los visibles en la tabla periódica de elementos .
Los protones y neutrones en el núcleo están sujetos a grandes fuerzas nucleares que los mantienen unidos, venciendo la repulsión electrostática entre los protones. A diferencia de los protones, los neutrones tienen un efecto positivo en el fortalecimiento de la fuerza nuclear. Se demostró que la relación entre el número de neutrones y protones debería ser de aproximadamente 1,5:1. Para átomos más ligeros por debajo de 20u, la relación estable es 1:1. De lo contrario, los núcleos tienden a desintegrarse. Todos los isótopos de elementos con un peso atómico superior a 208 son inestables.
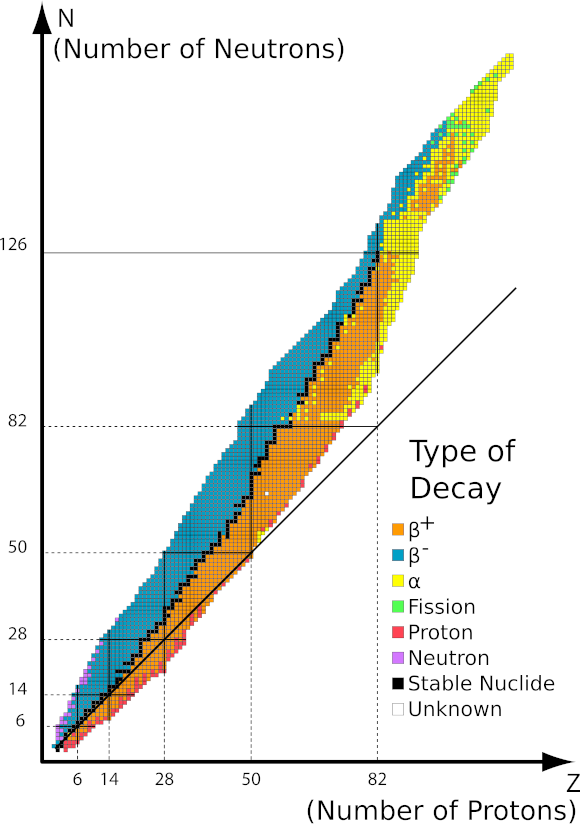
Imagen 1 Gráfico del área de estabilidad en función del número de nucleones en el núcleo. Fuente: http://ch302.cm.utexas.edu/nuclear/radioactivity/selector.php?name=band-stability
Este tipo de desintegraciones implican un cambio en el número de protones en el núcleo y, por lo tanto, también un cambio del elemento químico de uno a otro.
Experimentalmente, en 1909 E. Rutherford y T. Royds demostraron que las partículas alfa son idénticas a los iones de helio. Después de pasar la radiación alfa a través de las delgadas paredes de una cámara de vacío, la imagen de las líneas espectrales del espectrómetro óptico obtenida en la cámara de gas lo confirmó claramente. Por ejemplo, el núcleo de 240 Pu sufre radiación alfa, según la reacción: ![]() La radiación alfa se caracteriza por partículas cargadas positivamente con un alcance de varios centímetros en el aire y muy baja permeabilidad. Un trozo de papel los detendrá.
La radiación alfa se caracteriza por partículas cargadas positivamente con un alcance de varios centímetros en el aire y muy baja permeabilidad. Un trozo de papel los detendrá.
En el caso de la radiación beta-menos, se emiten electrones provenientes del núcleo. Dado que los núcleos no se caracterizan por la presencia de electrones, se forman solo durante la desintegración y, además de ellos, también se emite una segunda partícula: el antineutrino electrónico. Debido al aumento en el número de protones en la molécula, el elemento en descomposición beta se transforma en otro elemento con un número atómico más alto. Un ejemplo de un curso de descomposición es consistente con este mecanismo: 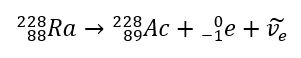 Esta radiación se caracteriza por partículas cargadas negativamente con un alcance de varias decenas de centímetros en el aire y una mayor permeabilidad en comparación con la radiación alfa. Está retenido por una lámina de aluminio con un espesor de unos 3 a 4 mm. La desintegración beta-plus ocurre de manera similar, pero emite partículas de positrones y neutrinos electrónicos. El número de protones en el núcleo disminuye y el elemento que lo sufre se transforma en otro de menor número atómico, como en el ejemplo:
Esta radiación se caracteriza por partículas cargadas negativamente con un alcance de varias decenas de centímetros en el aire y una mayor permeabilidad en comparación con la radiación alfa. Está retenido por una lámina de aluminio con un espesor de unos 3 a 4 mm. La desintegración beta-plus ocurre de manera similar, pero emite partículas de positrones y neutrinos electrónicos. El número de protones en el núcleo disminuye y el elemento que lo sufre se transforma en otro de menor número atómico, como en el ejemplo: 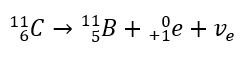
Es el único tipo de radiación que no transforma un elemento en otro, porque no emite ninguna partícula, solo la propia radiación gamma. Es uno de los tipos de ondas electromagnéticas, similar a la luz infrarroja o ultravioleta, pero la onda de radiación gamma es la más corta. El proceso de desintegración provoca la transición del núcleo excitado del átomo a un estado de menor energía, lo que da como resultado la emisión de fotones con la energía equivalente al núcleo del átomo en estados individuales. El diagrama del curso de la descomposición gamma se puede escribir como: ![]() La característica de la radiación gamma es su identificación con una onda electromagnética de alta frecuencia y de naturaleza luminosa. El rango en el aire es teóricamente ilimitado, mientras que la permeabilidad es la mayor de todos los tipos de radiactividad. Sólo lo detiene un grueso muro o una capa de plomo de quince centímetros.
La característica de la radiación gamma es su identificación con una onda electromagnética de alta frecuencia y de naturaleza luminosa. El rango en el aire es teóricamente ilimitado, mientras que la permeabilidad es la mayor de todos los tipos de radiactividad. Sólo lo detiene un grueso muro o una capa de plomo de quince centímetros.
Encuentra tu lugar en el Grupo PCC. Conozca nuestra oferta y siga desarrollándose con nosotros.
Prácticas de verano no remuneradas para alumnos y egresados de todos los cursos.