Das Phänomen der Radioaktivität wurde erstmals 1896 während des Experiments von Henri Becquerel mit Röntgenstrahlung (X) beobachtet. Sein Experiment sollte die These bestätigen, dass die aus Uran bestehenden Materialien Röntgenstrahlen aussenden, wenn sie das Sonnenlicht absorbieren.

Für den Test wurde eine fotografische Platte verwendet, die sich bei der Bestrahlung mit diesen Strahlen schwarz färbte. Das Experiment bewies, dass das Sonnenlicht nicht notwendig war, damit das Material das Schwärzen der Platte bewirkte. Dies widersprach jedoch der ursprünglichen Hypothese, so dass weitere Tests durchgeführt werden mussten. Diesmal sollten Röntgenstrahlen als Ursache für die Veränderung auf der Platte bestätigt oder ausgeschlossen werden. Ausgenutzt wurde die Tatsache, dass Röntgenstrahlen keine Ladung tragen und daher nicht durch ein Magnetfeld gekrümmt werden. In einer Vakuumkammer in einem Magnetfeld platzierte Becquerel ein uranhaltiges Material und eine fotografische Platte. Bei dem Experiment wurde entdeckt, dass sich die von der Probe ausgesandten Strahlen im Magnetfeld krümmten, was ihre Identität mit Röntgenstrahlen ausschloss. Im weiteren Verlauf der Forschung wies der Wissenschaftler nach, dass es drei Arten von Strahlung gibt, die Materialien aussenden können: neutrale, positiv und negativ geladene. Auf der Grundlage dieser Annahmen stellten die nachfolgenden Forscher ihre Thesen auf und führten weitere Experimente durch. Maria Skłodowska Curie und Pierre Curie entdeckten weitere radioaktive Elemente: Polonium und Radium. Ernest Rutherford, Nobelpreisträger für Chemie, widmete ebenfalls einen Teil seiner Karriere der Radioaktivität und benannte die von Becquerel entdeckten Strahlungsarten mit den griechischen Buchstaben des Alphabets: Alpha, Beta und Gamma.
Wie die Forschung gezeigt hat, ist Radioaktivität eine Eigenschaft einiger Elemente. Dies deutet darauf hin, dass sie eng mit ihrer atomaren Ebene und genauer gesagt mit dem Atomkern verbunden sind. Jede der drei Strahlungsarten ist ein Quant der Energie, die ein instabiler Atomkern aussenden kann. Das bedeutet, dass die Strahlung eigentlich das Ergebnis ihres Zerfalls ist. Das Auftreten solcher instabilen Kerne wird in der Praxis durch ihr Verhältnis von Protonen zu Neutronen verursacht. Aufgrund der verschiedenen Arten von Instabilität gibt es auch verschiedene Arten von Strahlung. Der Schlüssel zum Verständnis der Radioaktivität sind die Isotope und ihre Unterschiede auf atomarer Ebene. So ist beispielsweise das häufigste Kohlenstoffisotop 12C nicht radioaktiv, während 14C die Radioaktivität aufweist. Ihre Ordnungszahl und damit die Anzahl der Protonen ist gleich. Der Unterschied kann auch nicht auf die Anzahl der Elektronen zurückzuführen sein, da das Atom dann zu einem positiv oder negativ geladenen Ion werden würde. Die einzige Möglichkeit ist im Falle der Isotope die unterschiedliche Anzahl der Neutronen des Atomkerns. 14C hat zwei Neutronen mehr als 12C und ist somit auch schwerer als dieses. Das Vorhandensein von Isotopen für alle Elemente bewirkt, dass auch die Menge an radioaktiven Kernen groß ist. Solche instabilen und radioaktiven Isotope werden als Radioisotope bezeichnet, aber ihre Verbreitung ist nicht so groß wie die der Elemente, die im Periodensystem sichtbar sind.
Die Protonen und Neutronen im Kern sind sehr großen Kernkräften ausgesetzt, die sie zusammenhalten, indem sie die elektrostatische Abstoßung zwischen den Protonen überwinden. Im Gegensatz zu Protonen haben Neutronen eine positive Wirkung auf die Verstärkung der Kernkräfte. Es wurde nachgewiesen, dass das Verhältnis von Neutronen zu Protonen etwa 1,5:1 betragen sollte. Für leichtere Atome unter 20u beträgt das stabile Verhältnis 1:1, ansonsten neigen die Kerne zum Zerfall. Alle Isotope von Elementen mit einer Atommasse über 208 sind instabil.
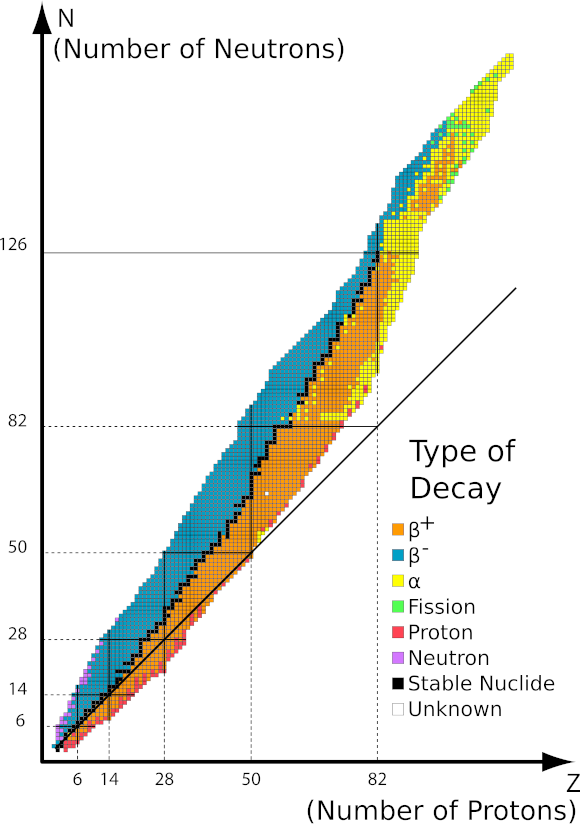
Abbildung 1 Diagramm des Stabilitätsbereichs in Abhängigkeit von der Anzahl der Nukleonen im Kern. Quelle: http://ch302.cm.utexas.edu/nuclear/radioactivity/selector.php?name=band-stability
Das oben dargestellte Diagramm zeigt die Abhängigkeit der Stabilität des Kerns von der Anzahl der einzelnen Nukleonen. Die schwarze Linie entspricht einem Verhältnis von Neutronen zu Protonen von 1:1. Stabile Isotope sind durch schwarze Quadrate gekennzeichnet, während instabile Isotope mit den entsprechenden Farben gemäß der Legende gekennzeichnet sind. Die Stabilität der radioaktiven Isotope ist umso größer, je näher sie am stabilen Verhältnis liegen. Dem Diagramm zufolge können wir zwischen drei Arten des Zerfalls unterscheiden:
Diese Arten der Zerfälle sind mit einer Veränderung der Anzahl der Protonen im Kern und somit auch mit einer Veränderung des chemischen Elements von einem zum anderen verbunden.
Experimentell wiesen im Jahr 1909 E. Rutherford und T. Royds nach, dass Alpha-Teilchen mit Helium-Ionen identisch sind. Nachdem die Alphastrahlung durch die dünnen Wände der Vakuumkammer durchgelassen wurde, bestätigte das Bild der Spektrallinien des in der Kammer erhaltenen Gases auf dem optischen Spektrometer dies eindeutig. Der Alphastrahlung unterliegt z.B. der Kern von 240Pu entsprechend der Reaktion:
![]()
Charakteristisch für Alphastrahlung sind positiv geladene Teilchen mit einer Reichweite von mehreren Zentimetern in Luft und sehr geringer Durchlässigkeit. Sie werden durch ein Blatt Papier aufgehalten.
Bei der Beta-Minus-Strahlung werden Elektronen emittiert, die aus dem Atomkern stammen. Da sich Kerne nicht durch das Vorhandensein von Elektronen auszeichnen, entstehen diese erst beim Zerfall, wobei zusätzlich ein zweites Teilchen, das Elektron-Antineutrino, emittiert wird. Durch die Zunahme der Protonenzahl im Molekül verwandelt sich das beta-zerfallende Element in ein anderes Element mit einer höheren Ordnungszahl. Ein Beispiel für einen Zerfallsverlauf nach diesem Mechanismus:
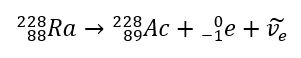
Diese Strahlung zeichnet sich durch negativ geladene Teilchen mit einer Reichweite von mehreren zehn Zentimetern in der Luft und einer höheren Durchlässigkeit im Vergleich zur Alpha-Strahlung aus. Sie wird durch eine etwa 3-4 mm dicke Aluminiumplatte aufgehalten.
Ähnlich verläuft der Zerfall nach dem Beta-Plus-Mechanismus, bei dem jedoch Positron- und Elektron-Neutrino-Teilchen emittiert werden. Die Anzahl der Protonen im Kern nimmt ab, und das betreffende Element verwandelt sich in ein anderes mit einer kleineren Ordnungszahl, wie im folgenden Beispiel:
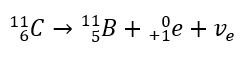
Sie ist die einzige Art von Strahlung, die keine Umwandlung eines Elements in ein anderes bewirkt, da sie keine Teilchen emittiert, sondern nur die Gammastrahlung selbst. Sie ist eine der Arten von elektromagnetischen Wellen, ähnlich wie Infrarot oder Ultraviolett, die Welle der Gammastrahlung ist jedoch die kürzeste. Der Zerfallsprozess bewirkt, dass der angeregte Kern eines Atoms in einen niedrigeren Energiezustand übergeht, was zur Emission von Photonen führt, deren Energie der des Atomkerns in den einzelnen Zuständen entspricht. Das Schema des Gamma-Zerfalls kann wie folgt beschrieben werden:
![]()
Die Eigenschaft der Gammastrahlung ist die Identifikation mit einer hochfrequenten elektromagnetischen Welle und einer lichtähnlichen Natur. Die Reichweite in der Luft ist theoretisch unbegrenzt, während die Durchlässigkeit die höchste aller Arten von Radioaktivität ist. Sie wird nur durch eine dicke Mauer oder eine fünfzehn Zentimeter dicke Bleischicht aufgehalten.
Finden Sie Ihren Platz in der PCC-Gruppe. Informieren Sie sich über unser Angebot und wachsen Sie mit uns.
Ein unbezahltes Sommerpraktikumsprogramm für Studenten und Hochschulabsolventen aller Fachrichtungen.