Het fenomeen radioactiviteit (of radioactieve emissie) werd voor het eerst waargenomen tijdens het experiment van Henri Becquerel met röntgenstralen (röntgenstraling) in 1896. Zijn experiment was bedoeld om de stelling te bevestigen met betrekking tot materialen gemaakt van uranium, volgens welke het X-straling zou moeten uitzenden. stralen na het absorberen van zonlicht.

Om de test uit te voeren werd een fotografische film gebruikt, die onder invloed van deze stralen zwart werd. Het experiment heeft aangetoond dat zonnestraling niet nodig is voor het testmateriaal om de film zwart te maken. Dit was echter in tegenspraak met de oorspronkelijke hypothese, dus er moest verder onderzoek worden gedaan. Deze keer was het de taak om röntgenstralen te bevestigen of te ontkennen als de factor die de verandering in de film veroorzaakte. Er werd gebruik gemaakt van het feit dat röntgenstralen geen lading dragen, dus niet worden afgebogen door het magnetische veld. Becquerel plaatste een uraniumhoudend materiaal en de fotografische film in een vacuümkamer in een magnetisch veld. Als resultaat van het experiment werd ontdekt dat de stralen die door het geteste monster worden uitgezonden, in het magnetische veld buigen, wat betekende dat het niet hetzelfde was als röntgenstralen. Tijdens het voortzetten van zijn onderzoek toonde de wetenschapper aan dat er drie soorten straling zijn die materialen kunnen uitzenden: neutraal, positief geladen en negatief geladen. Op basis van deze aannames hebben latere onderzoekers hun stellingen naar voren gebracht en verdere experimenten uitgevoerd. Maria Skłodowska Curie en Pierre Curie ontdekten de volgende radioactieve elementen: polonium en radium. Ernest Rutherford, een Nobelprijswinnaar in de chemie , wijdde ook een deel van zijn carrière aan radioactiviteit en noemde de door Becquerel ontdekte soorten straling met de Griekse letters van het alfabet: alfa, bèta en gamma.
Onderzoek heeft aangetoond dat radioactiviteit een kenmerk is van sommige elementen. Dit geeft de nauwe relatie aan met hun atomaire niveau, en meer specifiek – met de atoomkern. Elk van de drie soorten straling is een hoeveelheid energie die een onstabiele kern kan uitzenden. Dit betekent dat de straling eigenlijk het resultaat is van hun verval. Het ontstaan van dergelijke onstabiele kernen wordt in de praktijk veroorzaakt door hun verhouding van protonen tot neutronen. Door de verschillende soorten instabiliteit zijn er ook verschillende soorten straling. De sleutel tot het begrijpen van radioactiviteit zijn isotopen en hun verschillen op atomair niveau. De meest voorkomende koolstofisotoop 12 C is bijvoorbeeld niet radioactief, terwijl 14 C wel radioactief is. Hun atoomnummer , en dus het aantal protonen, is hetzelfde. Het verschil kan ook niet te wijten zijn aan het aantal elektronen, omdat het atoom dan een positief of negatief geladen ion zou zijn. De enige mogelijkheid, in het geval van isotopen, zijn verschillen in het aantal neutronen in de kern. 14 C heeft twee neutronen meer dan 12 C en is dus ook zwaarder. Het bestaan van isotopen voor alle elementen betekent dat ook het aantal radioactieve kernen groot is. Dergelijke onstabiele en radioactieve isotopen worden radio-isotopen genoemd, maar hun prevalentie is niet zo hoog als die zichtbaar zijn in het periodiek systeem der elementen .
De protonen en neutronen in de kern zijn onderhevig aan grote nucleaire krachten die ze bij elkaar houden, waardoor de elektrostatische afstoting tussen de protonen wordt overwonnen. In tegenstelling tot protonen hebben neutronen een positief effect op het versterken van de kernkracht. Er werd aangetoond dat de verhouding van het aantal neutronen tot protonen ongeveer 1,5:1 zou moeten zijn. Voor lichtere atomen onder de 20u is de stabiele verhouding 1:1. Anders hebben de kernen de neiging uiteen te vallen. Alle isotopen van elementen met een atoomgewicht van meer dan 208 zijn instabiel.
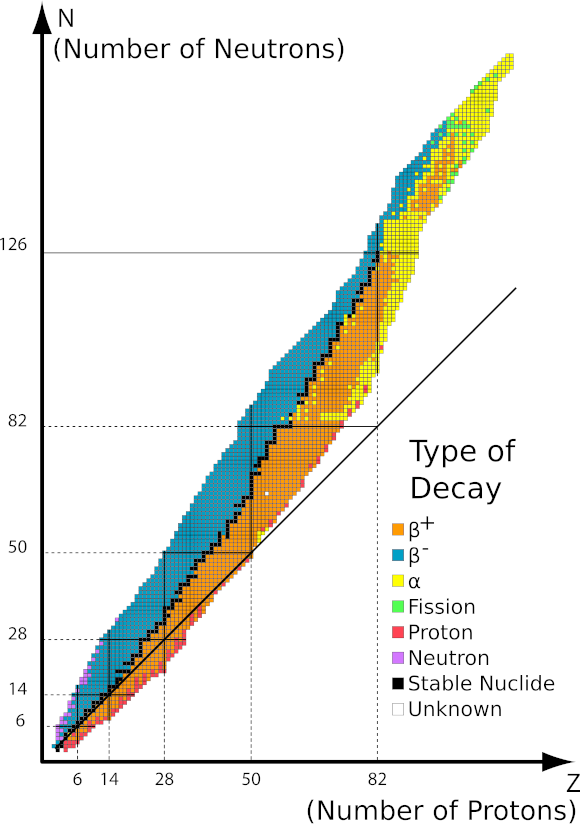
Afbeelding 1 Grafiek van het stabiliteitsgebied afhankelijk van het aantal nucleonen in de kern. Bron: http://ch302.cm.utexas.edu/nuclear/radioactivity/selector.php?name=band-stability
Dit soort verval brengt een verandering in het aantal protonen in de kern met zich mee, en dus ook een verandering van het chemische element van het ene naar het andere.
Experimenteel toonden E. Rutherford en T. Royds in 1909 aan dat alfadeeltjes identiek zijn aan heliumionen. Nadat de alfastraling door de dunne wanden van een vacuümkamer was gegaan, bevestigde het beeld van de spectraallijnen op de optische spectrometer verkregen in de gaskamer dit duidelijk. De 240 Pu-kern ondergaat bijvoorbeeld alfastraling, volgens de reactie: ![]() Alfastraling wordt gekenmerkt door positief geladen deeltjes met een bereik van enkele centimeters in de lucht en een zeer lage doorlaatbaarheid. Een stuk papier zal ze tegenhouden.
Alfastraling wordt gekenmerkt door positief geladen deeltjes met een bereik van enkele centimeters in de lucht en een zeer lage doorlaatbaarheid. Een stuk papier zal ze tegenhouden.
Bij bèta-minusstraling worden vanuit de kern elektronen uitgezonden. Omdat kernen niet worden gekenmerkt door de aanwezigheid van elektronen, worden ze alleen gevormd tijdens het verval, en daarnaast wordt ook een tweede deeltje uitgezonden – het elektron-anti-neutrino. Door de toename van het aantal protonen in het molecuul verandert het bèta-vervallende element in een ander element met een hoger atoomnummer. Een voorbeeld van een vervalverloop komt overeen met dit mechanisme: 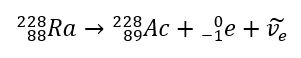 Deze straling wordt gekenmerkt door negatief geladen deeltjes met een bereik van enkele tientallen centimeters in de lucht en een grotere doorlaatbaarheid in vergelijking met alfastraling. Het wordt tegengehouden door een aluminium plaat met een dikte van ongeveer 3 tot 4 mm. Beta-plus-verval vindt op dezelfde manier plaats, maar het zendt positrondeeltjes en elektronenneutrino’s uit. Het aantal protonen in de kern neemt af en het element dat het ondergaat wordt getransformeerd in een ander element met een lager atoomnummer, zoals in het voorbeeld:
Deze straling wordt gekenmerkt door negatief geladen deeltjes met een bereik van enkele tientallen centimeters in de lucht en een grotere doorlaatbaarheid in vergelijking met alfastraling. Het wordt tegengehouden door een aluminium plaat met een dikte van ongeveer 3 tot 4 mm. Beta-plus-verval vindt op dezelfde manier plaats, maar het zendt positrondeeltjes en elektronenneutrino’s uit. Het aantal protonen in de kern neemt af en het element dat het ondergaat wordt getransformeerd in een ander element met een lager atoomnummer, zoals in het voorbeeld: 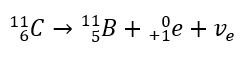
Het is het enige type straling dat het ene element niet in het andere verandert, omdat het geen deeltjes uitzendt, alleen gammastraling zelf. Het is een van de soorten elektromagnetische golven, vergelijkbaar met infrarood of ultraviolet licht, maar de gammastralingsgolf is de kortste. Het vervalproces veroorzaakt de overgang van de aangeslagen kern van het atoom naar een toestand van lagere energie, resulterend in de emissie van fotonen met het energie-equivalent van de kern van het atoom in individuele toestanden. Het diagram van het verloop van gammaverval kan worden geschreven als: ![]() Het kenmerk van gammastraling is de identificatie met een elektromagnetische golf van hoogfrequente en lichtachtige aard. Het bereik in lucht is theoretisch onbeperkt, terwijl de doorlaatbaarheid de grootste is van alle soorten radioactiviteit. Het wordt alleen tegengehouden door een dikke muur of een laag lood van vijftien centimeter.
Het kenmerk van gammastraling is de identificatie met een elektromagnetische golf van hoogfrequente en lichtachtige aard. Het bereik in lucht is theoretisch onbeperkt, terwijl de doorlaatbaarheid de grootste is van alle soorten radioactiviteit. Het wordt alleen tegengehouden door een dikke muur of een laag lood van vijftien centimeter.
Vind je plek bij de PCC Group. Maak kennis met ons aanbod en blijf samen met ons ontwikkelen.
Onbetaalde zomerstages voor studenten en afgestudeerden van alle opleidingen.