Le phénomène de radioactivité (ou émission radioactive) a été observé pour la première fois lors de l'expérience d'Henri Becquerel sur les rayons X (rayonnement Roentgen) en 1896. Son expérience devait confirmer la thèse concernant les matériaux constitués d'uranium, selon laquelle il était censé émettre du X- rayons après avoir absorbé la lumière du soleil.

Pour effectuer le test, un film photographique a été utilisé, qui a noirci sous l’influence de ces rayons. L’expérience a montré que le rayonnement solaire n’est pas nécessaire pour que le matériau d’essai noircisse le film. Cependant, cela contredisait l’hypothèse initiale, de sorte que des recherches supplémentaires ont dû être menées. Cette fois, la tâche était de confirmer ou d’infirmer que les rayons X étaient le facteur provoquant le changement du film. Le fait que les rayons X ne portent aucune charge, donc ils ne sont pas courbés par le champ magnétique, a été utilisé. Becquerel a placé un matériau contenant de l’uranium et le film photographique dans une chambre à vide située dans un champ magnétique. À la suite de l’expérience, il a été découvert que les rayons émis par l’échantillon testé se plient dans le champ magnétique, ce qui signifie que ce n’était pas la même chose que les rayons X. Au cours de la poursuite de ses recherches, le scientifique a montré qu’il existe trois types de rayonnement que les matériaux peuvent émettre – neutre, chargé positivement et chargé négativement. Sur la base de ces hypothèses, les chercheurs suivants ont présenté leurs thèses et mené d’autres expériences. Maria Skłodowska Curie et Pierre Curie ont découvert les éléments radioactifs suivants : le polonium et le radium. Ernest Rutherford, prix Nobel de chimie , a également consacré une partie de sa carrière à la radioactivité et a nommé les types de rayonnement découverts par Becquerel avec les lettres grecques de l’alphabet : alpha, bêta et gamma.
La recherche a montré que la radioactivité est une caractéristique de certains éléments. Cela indique sa relation étroite avec leur niveau atomique, et plus précisément – avec le noyau atomique. Chacun des trois types de rayonnement est un quantum d’énergie qu’un noyau instable peut émettre. Cela signifie que le rayonnement est en fait le résultat de leur désintégration. L’apparition de tels noyaux instables est en pratique causée par leur rapport protons/neutrons. En raison des différents types d’instabilité, il existe également différents types de rayonnement. La clé pour comprendre la radioactivité réside dans les isotopes et leurs différences au niveau atomique. Par exemple, l’isotope de carbone le plus courant, le 12 C, n’est pas radioactif, tandis que le 14 C est radioactif. Leur numéro atomique , et donc le nombre de protons, est le même. La différence ne peut pas non plus être due au nombre d’électrons, car l’atome serait alors un ion chargé positivement ou négativement. La seule possibilité, dans le cas des isotopes, sont des différences dans le nombre de neutrons dans le noyau. Le 14 C a deux neutrons de plus que le 12 C, il est donc aussi plus lourd. L’existence d’isotopes pour tous les éléments signifie que le nombre de noyaux radioactifs est également important. Ces isotopes instables et radioactifs sont appelés radio-isotopes, mais leur prévalence n’est pas aussi élevée que celle visible dans le tableau périodique des éléments .
Les protons et les neutrons du noyau sont soumis à d’importantes forces nucléaires qui les maintiennent ensemble, surmontant la répulsion électrostatique entre les protons. Contrairement aux protons, les neutrons ont un effet positif sur le renforcement de la force nucléaire. Il a été montré que le rapport du nombre de neutrons aux protons devrait être d’environ 1,5:1. Pour les atomes plus légers en dessous de 20u, le rapport stable est de 1:1. Sinon, les noyaux ont tendance à se désintégrer. Tous les isotopes des éléments dont le poids atomique est supérieur à 208 sont instables.
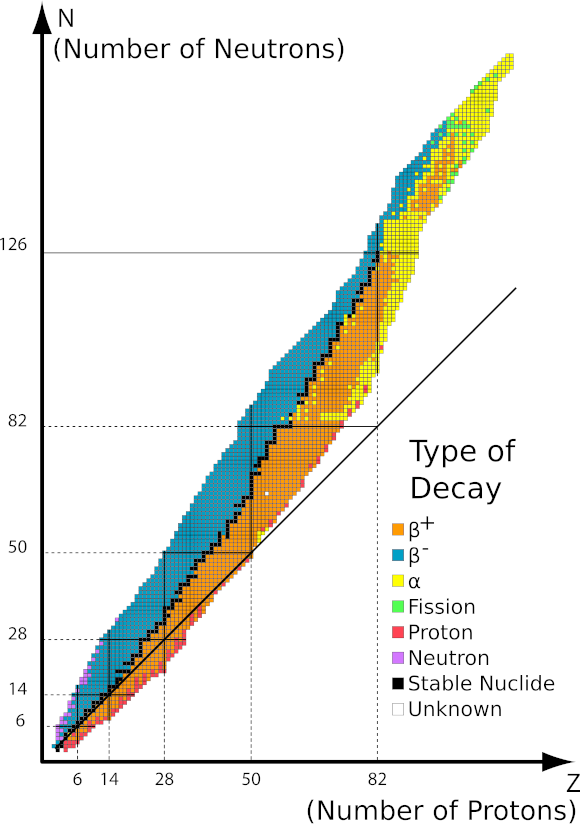
Image 1 Graphique de l’aire de stabilité en fonction du nombre de nucléons dans le noyau. Source : http://ch302.cm.utexas.edu/nuclear/radioactivity/selector.php?name=band-stability
Ces types de désintégrations impliquent un changement du nombre de protons dans le noyau, et donc aussi un changement d’élément chimique de l’un à l’autre.
Expérimentalement, en 1909, E. Rutherford et T. Royds ont montré que les particules alpha sont identiques aux ions d’hélium. Après avoir fait passer le rayonnement alpha à travers les parois minces d’une chambre à vide, l’image des raies spectrales sur le spectromètre optique obtenue dans la chambre à gaz l’a clairement confirmé. Par exemple, le noyau 240 Pu subit un rayonnement alpha, selon la réaction : ![]() Le rayonnement alpha est caractérisé par des particules chargées positivement d’une portée de plusieurs centimètres dans l’air et de très faible perméabilité. Un morceau de papier les arrêtera.
Le rayonnement alpha est caractérisé par des particules chargées positivement d’une portée de plusieurs centimètres dans l’air et de très faible perméabilité. Un morceau de papier les arrêtera.
Dans le cas d’un rayonnement bêta moins, des électrons provenant du noyau sont émis. Étant donné que les noyaux ne sont pas caractérisés par la présence d’électrons, ils ne se forment que lors de la désintégration et, en plus d’eux, une deuxième particule est également émise – l’électron anti-neutrino. En raison de l’augmentation du nombre de protons dans la molécule, l’élément en désintégration bêta se transforme en un autre élément avec un numéro atomique plus élevé. Un exemple de cours de désintégration est cohérent avec ce mécanisme : 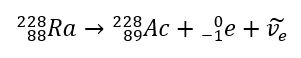 Ce rayonnement se caractérise par des particules chargées négativement d’une portée de plusieurs dizaines de centimètres dans l’air et d’une plus grande perméabilité par rapport au rayonnement alpha. Il est arrêté par une tôle d’aluminium d’une épaisseur d’environ 3 à 4 mm. La désintégration bêta-plus se produit de la même manière, mais elle émet des particules de positons et des neutrinos électroniques. Le nombre de protons dans le noyau diminue et l’élément qui le subit se transforme en un autre de numéro atomique inférieur, comme dans l’exemple :
Ce rayonnement se caractérise par des particules chargées négativement d’une portée de plusieurs dizaines de centimètres dans l’air et d’une plus grande perméabilité par rapport au rayonnement alpha. Il est arrêté par une tôle d’aluminium d’une épaisseur d’environ 3 à 4 mm. La désintégration bêta-plus se produit de la même manière, mais elle émet des particules de positons et des neutrinos électroniques. Le nombre de protons dans le noyau diminue et l’élément qui le subit se transforme en un autre de numéro atomique inférieur, comme dans l’exemple : 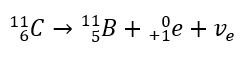
C’est le seul type de rayonnement qui ne transforme pas un élément en un autre, car il n’émet aucune particule, seulement le rayonnement gamma lui-même. C’est l’un des types d’ondes électromagnétiques, au même titre que la lumière infrarouge ou ultraviolette, mais l’onde de rayonnement gamma est la plus courte. Le processus de désintégration provoque la transition du noyau excité de l’atome vers un état d’énergie inférieure, entraînant l’émission de photons avec l’équivalent énergétique du noyau de l’atome dans des états individuels. Le diagramme de l’évolution de la désintégration gamma peut s’écrire : ![]() La caractéristique du rayonnement gamma est son identification avec une onde électromagnétique de haute fréquence et de nature lumineuse. La portée dans l’air est théoriquement illimitée, tandis que la perméabilité est la plus grande de tous les types de radioactivité. Il n’est arrêté que par un mur épais ou une couche de plomb de quinze centimètres.
La caractéristique du rayonnement gamma est son identification avec une onde électromagnétique de haute fréquence et de nature lumineuse. La portée dans l’air est théoriquement illimitée, tandis que la perméabilité est la plus grande de tous les types de radioactivité. Il n’est arrêté que par un mur épais ou une couche de plomb de quinze centimètres.
Trouvez votre place au sein du groupe PCC. Découvrez notre offre et continuez à vous développer avec nous.
Stages d’été non rémunérés pour étudiants et diplômés de toutes les filières.