Il fenomeno della radioattività (o emissione radioattiva) fu osservato per la prima volta durante l'esperimento di Henri Becquerel sui raggi X (radiazione Roentgen) nel 1896. Il suo esperimento doveva confermare la tesi riguardante i materiali fatti di uranio, secondo i quali avrebbe dovuto emettere X- raggi dopo aver assorbito la luce solare.

Per eseguire il test è stata utilizzata una pellicola fotografica, che si è annerita sotto l’influenza di questi raggi. L’esperimento ha dimostrato che la radiazione solare non è necessaria affinché il materiale di prova annerisca la pellicola. Tuttavia, ciò contraddiceva l’ipotesi iniziale, quindi è stato necessario condurre ulteriori ricerche. Questa volta, il compito era confermare o smentire i raggi X come fattore che ha causato il cambiamento nel film. È stato sfruttato il fatto che i raggi X non portano alcuna carica, quindi non sono piegati dal campo magnetico. Becquerel mise un materiale contenente uranio e la pellicola fotografica in una camera a vuoto situata in un campo magnetico. Come risultato dell’esperimento, si scoprì che i raggi emessi dal campione testato si piegavano nel campo magnetico, il che significava che non era la stessa cosa dei raggi X. Continuando la sua ricerca, lo scienziato ha dimostrato che ci sono tre tipi di radiazioni che i materiali possono emettere: neutri, caricati positivamente e caricati negativamente. Sulla base di questi presupposti, i successivi ricercatori hanno avanzato le loro tesi e condotto ulteriori esperimenti. Maria Skłodowska Curie e Pierre Curie hanno scoperto i prossimi elementi radioattivi: il polonio e il radio. Anche Ernest Rutherford, premio Nobel per la chimica , dedicò una parte della sua carriera alla radioattività e chiamò i tipi di radiazione scoperti da Becquerel con le lettere greche dell’alfabeto: alfa, beta e gamma.
La ricerca ha dimostrato che la radioattività è una caratteristica di alcuni elementi. Ciò indica la sua stretta relazione con il loro livello atomico e, più specificamente, con il nucleo atomico. Ciascuno dei tre tipi di radiazione è un quanto di energia che un nucleo instabile può emettere. Ciò significa che la radiazione è in realtà il risultato del loro decadimento. La presenza di tali nuclei instabili è in pratica causata dal loro rapporto tra protoni e neutroni. A causa dei diversi tipi di instabilità, esistono anche diversi tipi di radiazioni. La chiave per comprendere la radioattività sono gli isotopi e le loro differenze a livello atomico. Ad esempio, l’isotopo di carbonio più comune 12 C non è radioattivo, mentre 14 C è radioattivo. Il loro numero atomico , e quindi il numero di protoni, è lo stesso. La differenza inoltre non può essere dovuta al numero di elettroni, perché l’atomo sarebbe quindi uno ione caricato positivamente o negativamente. L’unica possibilità, nel caso degli isotopi, sono le differenze nel numero di neutroni nel nucleo. 14 C ha due neutroni in più rispetto a 12 C, quindi è anche più pesante. L’esistenza di isotopi per tutti gli elementi significa che anche il numero di nuclei radioattivi è elevato. Tali isotopi instabili e radioattivi sono chiamati radioisotopi, ma la loro prevalenza non è così alta come quelli visibili nella tavola periodica degli elementi .
I protoni ei neutroni nel nucleo sono soggetti a grandi forze nucleari che li tengono insieme, vincendo la repulsione elettrostatica tra i protoni. A differenza dei protoni, i neutroni hanno un effetto positivo sul rafforzamento della forza nucleare. È stato dimostrato che il rapporto tra il numero di neutroni e protoni dovrebbe essere di circa 1,5:1. Per atomi più leggeri inferiori a 20u, il rapporto stabile è 1:1. Altrimenti, i nuclei tendono a disintegrarsi. Tutti gli isotopi degli elementi con peso atomico superiore a 208 sono instabili.
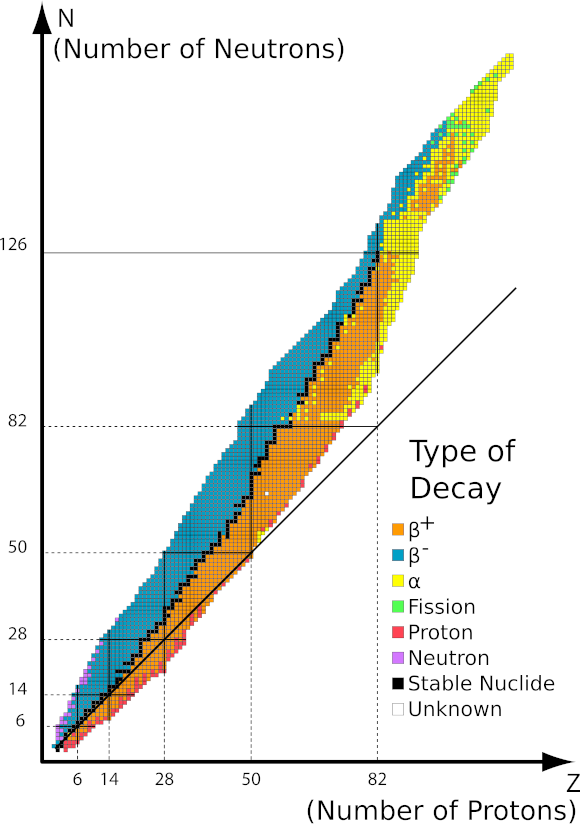
Figura 1 Grafico dell’area di stabilità in funzione del numero di nucleoni nel nucleo. Fonte: http://ch302.cm.utexas.edu/nuclear/radioactivity/selector.php?name=band-stability
Questi tipi di decadimenti comportano un cambiamento del numero di protoni nel nucleo, e quindi anche un cambiamento dell’elemento chimico dall’uno all’altro.
Sperimentalmente, nel 1909 E. Rutherford e T. Royds dimostrarono che le particelle alfa sono identiche agli ioni di elio. Dopo aver fatto passare la radiazione alfa attraverso le sottili pareti di una camera a vuoto, l’immagine delle righe spettrali sullo spettrometro ottico ottenuta nella camera a gas lo confermava chiaramente. Ad esempio, il nucleo di 240 Pu subisce radiazioni alfa, secondo la reazione: ![]() La radiazione alfa è caratterizzata da particelle cariche positivamente con un raggio d’azione di diversi centimetri nell’aria e una permeabilità molto bassa. Un pezzo di carta li fermerà.
La radiazione alfa è caratterizzata da particelle cariche positivamente con un raggio d’azione di diversi centimetri nell’aria e una permeabilità molto bassa. Un pezzo di carta li fermerà.
Nel caso della radiazione beta-meno, vengono emessi elettroni provenienti dal nucleo. Poiché i nuclei non sono caratterizzati dalla presenza di elettroni, si formano solo durante il decadimento e, oltre a questi, viene emessa anche una seconda particella: l’antineutrino elettronico. A causa dell’aumento del numero di protoni nella molecola, l’elemento in decadimento beta si trasforma in un altro elemento con un numero atomico più alto. Un esempio di corso di decadimento è coerente con questo meccanismo: 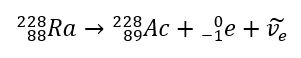 Questa radiazione è caratterizzata da particelle cariche negativamente con un raggio d’azione di diverse decine di centimetri nell’aria e una maggiore permeabilità rispetto alla radiazione alfa. È fermato da un foglio di alluminio con uno spessore di circa 3-4 mm. Il decadimento beta-plus avviene in modo simile, ma emette particelle di positroni e neutrini elettronici. Il numero di protoni nel nucleo diminuisce e l’elemento che lo subisce si trasforma in un altro con numero atomico inferiore, come nell’esempio:
Questa radiazione è caratterizzata da particelle cariche negativamente con un raggio d’azione di diverse decine di centimetri nell’aria e una maggiore permeabilità rispetto alla radiazione alfa. È fermato da un foglio di alluminio con uno spessore di circa 3-4 mm. Il decadimento beta-plus avviene in modo simile, ma emette particelle di positroni e neutrini elettronici. Il numero di protoni nel nucleo diminuisce e l’elemento che lo subisce si trasforma in un altro con numero atomico inferiore, come nell’esempio: 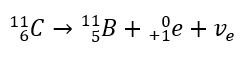
È l’unico tipo di radiazione che non trasforma un elemento in un altro, perché non emette particelle, ma solo radiazioni gamma. È uno dei tipi di onde elettromagnetiche, analogamente alla luce infrarossa o ultravioletta, ma l’onda di radiazione gamma è la più corta. Il processo di decadimento provoca la transizione del nucleo eccitato dell’atomo in uno stato di energia inferiore, con conseguente emissione di fotoni con l’energia equivalente del nucleo dell’atomo nei singoli stati. Il diagramma del corso del decadimento gamma può essere scritto come: ![]() La caratteristica della radiazione gamma è la sua identificazione con un’onda elettromagnetica ad alta frequenza e di natura simile alla luce. La portata in aria è teoricamente illimitata, mentre la permeabilità è la più grande di tutti i tipi di radioattività. È fermato solo da uno spesso muro o da uno strato di piombo di quindici centimetri.
La caratteristica della radiazione gamma è la sua identificazione con un’onda elettromagnetica ad alta frequenza e di natura simile alla luce. La portata in aria è teoricamente illimitata, mentre la permeabilità è la più grande di tutti i tipi di radioattività. È fermato solo da uno spesso muro o da uno strato di piombo di quindici centimetri.
Trova il tuo posto nel Gruppo PCC. Scopri la nostra offerta e continua a svilupparla con noi.
Stage estivi non retribuiti per studenti e laureati di tutti i corsi.