Las micelas son agrupaciones microscópicas de moléculas con una estructura esférica. Constituyen un grupo de compuestos tensioactivos (tensioactivos) de uso común y muy eficaz. Gracias a sus propiedades únicas, desempeñan un papel fundamental en diversas industrias, incluida la cosmetología.

Gracias a su estructura, las micelas absorben prácticamente todo tipo de impurezas de la superficie sobre la que se aplican. Se mencionan con mayor frecuencia en el contexto de los cosméticos de limpieza facial, pero también son ingredientes de productos como detergentes para ropa y lavavajillas. Las soluciones micelares se caracterizan por su capacidad para disolver compuestos poco solubles, lo que define el proceso de solubilización.
Estructura y propiedades de las micelas
La estructura de las micelas determina sus propiedades fisicoquímicas únicas. En esta sección, analizaremos cómo se forman, de qué están compuestas y qué procesos determinan su comportamiento en solución.
A través de los ojos de un químico
Las micelas no son más que coloides asociativos formados como resultado del proceso de micelización . Este proceso se refiere a la transformación de moléculas o iones anfifílicos que, como resultado de la disolución, se autoasocian en grupos más grandes. Por lo tanto, las micelas no son un grupo específico de compuestos químicos, sino una forma específica de organización de sus moléculas. Esta transformación espontánea que resulta en la formación de micelas es característica de diversas sustancias orgánicas cuyas moléculas se componen de dos partes con polaridades significativamente diferentes. Cuando el contenido de surfactantes en una solución aumenta, a una cierta concentración de asociados, estas estructuras características comienzan a formarse. El punto de partida de tales transformaciones se denomina concentración de CMC.
¿Qué significa CMC?
La CMC, o concentración crítica de micelización , es la concentración a la que comienzan a formarse micelas como resultado de la autocombinación de monómeros acumulados en agregados más grandes . Esta formación de grupos de moléculas también se acompaña de un cambio en sus propiedades físicas. Por encima de la CMC, dicho grupo de moléculas permanece en equilibrio con las moléculas individuales, adquiriendo así una forma termodinámicamente estable. Este equilibrio es un punto clave de transición, ya que puede continuar de forma continua en ambas direcciones. Por ejemplo, durante la dilución, las micelas se descomponen de nuevo. Por debajo de la concentración de CNC, las moléculas de surfactante se mueven libremente en la solución sin ninguna estructura organizada.
Propiedades físicas de las micelas
A medida que aumenta la concentración de surfactante en la solución, se producen los siguientes cambios:
- Tensión superficial,
- Conductividad eléctrica,
- Intensidad de dispersión de la luz,
- Viscosidad.
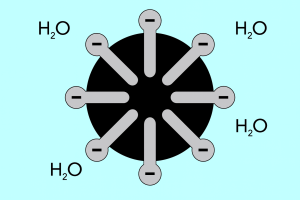
Cabeza y cola: estructura de las micelas
La estructura de las micelas se puede dividir en dos partes principales, que difieren significativamente en polaridad y se denominan:
- Cabeza hidrófila , con alta afinidad por el agua. Es la parte de la micela responsable de la tendencia de las partículas a combinarse con el agua, pero también de repeler las grasas.
- La cola hidrófoba , también conocida como cola lipofílica, que tiene el efecto opuesto: atrae moléculas de grasa y repele el agua.
La zona hidrofóbica está formada con mayor frecuencia por cadenas de hidrocarburos, radicales:
- alquilo,
- alquilarilo,
- radicales de hidrocarburos fluorados.
La zona hidrófila está formada por grupos que interactúan con suficiente fuerza con el agua, como los grupos ionógenos. Los grupos no iónicos, como los grupos éter, también pueden formar parte de la zona hidrófila de las micelas, pero esto suele requerir la presencia de un mayor número de grupos polares en la molécula.
El proceso de micelización
Debido a que la parte no polar de la sustancia, por ejemplo, la cadena alquílica de una molécula de surfactante dispersa, presenta una gran superficie en contacto con el agua, y la interacción entre varias moléculas de agua es mucho más intensa que su interacción con los grupos –CH₂ presentes en la cadena, la entropía del sistema disminuye y las moléculas de agua comienzan a organizarse en el sitio de la cadena alquílica. Esto provoca un desplazamiento de las cadenas de hidrocarburos del interior de la fase acuosa. A medida que aumenta la concentración del surfactante, también aumenta el número de colisiones entre ellas. Esto también aumenta la probabilidad de agregación y engrosamiento de las moléculas. La condensación de las moléculas se acompaña de una disminución de la entalpía libre. Esto también es el resultado de la combinación de residuos apolares con un núcleo apolar en estado líquido, separado de la fase acuosa por grupos polares.
Una vez alcanzada la concentración de CMC mencionada, es decir, la concentración micelar crítica, se acumulan cúmulos esféricos, en los que los grupos polares de las partículas individuales se dirigen hacia la fase acuosa, mientras que las cadenas de hidrocarburos apolares forman el interior. Las micelas formadas de esta manera se denominan micelas normales.
En disolventes orgánicos, pueden presentarse micelas inversas, en las que la parte hidrófoba se encuentra en el exterior.

Tipos y ejemplos de surfactantes
El tipo de surfactante utilizado para formar micelas tiene un gran impacto en su estructura y funcionalidad. A continuación, encontrará los tipos y ejemplos más comunes de surfactantes que forman micelas.
Ejemplos de iones tensioactivos
Iones con carga negativa, cationes:
- carboxilato,
- sulfato,
- sulfonato,
- fosfato.
Iones con carga positiva, cationes:
- amonio,
- fosfonio.
Tipos de surfactantes
- Tensioactivos iónicos
- Aniónico, por ejemplo SDS, o dodecilsulfato de sodio,
- Catiónico, por ejemplo CTAB, o bromuro de cetil trimetil amonio,
- Anfiones, es decir iones llamados anfifílicos o bipolares, que tienen a la vez un grupo catiónico cargado positivamente y un grupo aniónico cargado negativamente, por ejemplo la Lecitina, es decir la Fosfatidilolina.
- Tensioactivos no iónicos, por ejemplo Polioxietilenos.
Actividad superficial de los surfactantes y estructura micelar
Este parámetro, característico de los compuestos tensioactivos, aumenta con el número de grupos metileno presentes en la cadena de hidrocarburos.
Debido a la estructura de la cadena, las micelas se pueden dividir en:
- Cadena única
- Aniónico, por ejemplo SDS,
- Catiónico, por ejemplo CTAB.
- Doble cadena
- Aniónico, por ejemplo AOT, es decir, bis(2-etilhexil)succinatosulfonato de sodio,
- Catiónico, por ejemplo, bromuro de dihexadecildimetilamonio.
- Molecular, por ejemplo MGDG, es decir, diglicérido de monogalactosil.

Aplicación de micelas
Las micelas tienen una amplia gama de aplicaciones, desde la cosmetología hasta la industria farmacéutica y química. Conozca las áreas más importantes donde se utilizan sus propiedades en la práctica.
Limpieza eficaz de la piel
Esto es posible gracias a la presencia de partículas lipofílicas e hidrofílicas. Por ejemplo, en los desmaquillantes con agua micelar, las partículas hidrofóbicas se unen al sebo y los residuos de maquillaje de la piel, mientras que las hidrofílicas atraen el polvo y la suciedad. Esto produce un doble efecto limpiador, que permite una limpieza eficaz y profunda sin resecar ni irritar la piel. Los productos micelares se recomiendan incluso para pieles sensibles gracias a su acción suave. No es necesario frotar ni presionar con fuerza con discos de algodón, y la acción de estos coloides se compara con la de un imán sobre la suciedad. Las soluciones acuosas con micelas no alteran la capa hidrolipídica de la epidermis.
Formulación de cosméticos micelares
Otra ventaja de las micelas, que son partículas muy pequeñas, es que no hay restricciones en cuanto a su formulación. Se pueden usar en su forma más popular, el agua micelar, pero también en cremas y lociones. También existen fórmulas en gel altamente concentradas que no requieren el uso de toallas ni discos de algodón, sino que solo se masajean sobre la piel y se enjuagan con agua.
Acción de las micelas en tres etapas
- Atrayendo impurezas gracias a colas hidrofóbicas,
- Encapsulación , que atrapa las moléculas de grasa y suciedad dentro de las micelas,
- Eliminación de impurezas atrapadas en las micelas mediante cabezales hidrofílicos que permanecen en contacto con la fase acuosa.
Otras aplicaciones industriales de las micelas
- Cosmetología , principalmente líquidos micelares y lociones desmaquillantes, pero también champús micelares para la limpieza profunda del cuero cabelludo y geles de ducha.
- Farmacia , por ejemplo, para aumentar la biodisponibilidad de sustancias activas introduciendo en el organismo medicamentos con solubilidad limitada en forma de soluciones micelares no iónicas.
- Productos de limpieza : el proceso de solubilización mencionado anteriormente explica la fisicoquímica del lavado. Los coloides micelares en forma de solución envuelven la grasa, separan la suciedad y la eliminan del tejido. Cuando se utilizan tensioactivos iónicos, las partículas de suciedad y la superficie a la que se adhieren adquieren la misma carga, lo que facilita su separación.
- Procesos físicos y químicos : catálisis micelar, inhibición de reacciones químicas, procesos de flotación y recuperación de petróleo.
- Witek K. Synteza, właściwości powierzchniowe i zastosowanie surfaktantów amfoterycznych, zawierających ugrupowania labilne, Politechnika Wrocławska 2022
- K.Michocka Otrzymywanie i właściwości użytkowe nowych surfaktantów z ugrupowaniem cukrowym, Uniwersytet Ekonomiczny w Poznaniu 2012
- A.Piotrowska-Kirschling, J.Drzeżdżon, L.Chmurzyński, D.Jacewicz Krytyczne stężenie micelarne i metody jego wyznaczania, Wiadomości chemiczne 2018
- https://wydawnictwo.ue.poznan.pl/books/978-83-8211-090-6/sample.pdf
- https://home.agh.edu.pl/~nmos1/FUK/fizykochemia_powierzchni_skany/15/dutkiewicz_15.pdf
- https://phavi.umcs.pl/at/attachments/2018/0608/143246-chemia-koloidow-cwiczenie-1.pdf



























































































































