เป็นหนึ่งในสองแผนกหลักของเคมีวิเคราะห์ ซึ่งเกี่ยวข้องกับการตรวจจับองค์ประกอบทางเคมี หมู่ฟังก์ชัน หรือไอออนที่มีอยู่ในโครงสร้างที่ทดสอบ ในแง่ของวิธีการที่ใช้ เราสามารถแบ่งการวิเคราะห์ทางเคมีออกเป็นการวิเคราะห์แบบดั้งเดิมและการวิเคราะห์ด้วยเครื่องมือ การวิเคราะห์แบบคลาสสิกอาศัยวิธีการที่อิงจากปฏิกิริยาเคมีซึ่งอาจดำเนินการในโหมด "แห้ง" หรือ "เปียก" ในทางตรงกันข้าม การวิเคราะห์ด้วยเครื่องมืออาศัยเครื่องมือ นั่นคือ เครื่องมือวัดเชิงวิเคราะห์ที่มีองค์ประกอบหลักเป็นตัวตรวจจับ

การวิเคราะห์แบบคลาสสิก: ปฏิกิริยาแห้ง
คำว่า "ปฏิกิริยาแห้ง" หมายถึงการเปลี่ยนแปลงที่เกิดขึ้นในสารประกอบทางเคมีในขณะที่อยู่ภายใต้อุณหภูมิสูง เราจำแนกปฏิกิริยาดังกล่าวออกเป็นสามประเภทหลัก:
- ละลายตัวอย่างที่ทดสอบด้วยฟลักซ์ที่เป็นของแข็ง
- การได้รับบอแรกซ์หรือเม็ดเกลือไมโครคอสมิก
- ระบายสีเปลวไฟเตาแก๊ส
วิธีที่ได้รับความนิยมมากที่สุดคือวิธีที่ 3 ซึ่งเรียกว่าการทดสอบเปลวไฟและช่วยให้สามารถตรวจจับองค์ประกอบต่างๆ ได้มากมาย นี่คือตัวอย่างของเทคนิคที่ใช้การปล่อยรังสี ประกอบด้วยการตรวจสอบลักษณะการแผ่รังสีที่ปล่อยออกมาจากอะตอมของธาตุเฉพาะเมื่อถูกกระตุ้นด้วยอุณหภูมิสูง นี่เป็นเพราะมีการพิสูจน์แล้วว่าสภาวะดังกล่าวทำให้เกิดการระเหยของสารประกอบของโลหะบางชนิด และไอระเหยที่เกิดขึ้นจะกระตุ้นและทำให้เปลวไฟของหัวเผามีลักษณะเฉพาะ สีเป็นผลจากการกระตุ้นของอะตอมเฉพาะซึ่งในขณะที่ถูกคืนสู่สถานะเดิม จะปล่อยควอนตัมแสงที่อ้างอิงถึงความยาวคลื่นที่ระบุ ตัวอย่างเช่น ลักษณะสีเปลวไฟขององค์ประกอบเฉพาะมีดังนี้:
- โซเดียม: สีเหลืองเข้มข้น,
- โพแทสเซียม: สีม่วง,
- แคลเซียม: สีแดงอิฐ,
- แบเรียม: สีเขียว,
- บิสมัท: สีฟ้าอ่อน
การวิเคราะห์แบบคลาสสิก: ปฏิกิริยาเปียก
นี่คือปฏิกิริยาทุกประเภทที่เกิดขึ้นระหว่างตัวอย่างที่ทดสอบกับสารละลายของ รีเอเจนต์เคมี ต่างๆ ในการดำเนินปฏิกิริยาดังกล่าว จะต้องเปลี่ยนสารที่ทดสอบให้เป็นสารละลาย ปฏิกิริยาที่ใช้จะถูกเลือกตามเกณฑ์ต่างๆ เพื่อให้:
- แสดงความไวสูง เช่น เกิดขึ้นแล้วเมื่อตรวจพบสารที่มีความเข้มข้นต่ำ
- เกิดขึ้นในช่วงเวลาสั้น ๆ และแสดงการเปลี่ยนแปลงที่สังเกตได้ง่าย เช่น การเปลี่ยนแปลงสีของสารละลาย ตกตะกอน หรือมีการปล่อยก๊าซ
- เป็นการคัดเลือก กล่าวคือ เกิดขึ้นภายในกลุ่มไอออนที่รู้จักเท่านั้น

การวิเคราะห์เชิงคุณภาพ: เคมีอนินทรีย์
ใน เคมีอนินทรีย์ การวิเคราะห์เชิงคุณภาพเกี่ยวข้องกับสองหัวข้อ: การตรวจจับไอออนบวกและประจุลบ เคมีอนินทรีย์ใช้ปฏิกิริยาที่มีลักษณะเฉพาะที่เกี่ยวข้องกับรีเอเจนต์กลุ่มที่เหมาะสม พวกเขาถูกเรียกว่า "กลุ่มรีเอเจนต์" เนื่องจากไอออนบวกถูกแบ่งออกเป็นห้าประเภท รีเอเจนต์ดังกล่าวก่อให้เกิดตะกอนโดยมีเพียงหนึ่งในนั้น ซึ่งทำให้สามารถจำกัดประเภทของไอออนบวกที่มีอยู่ในตัวอย่างให้แคบลงตามรูปแบบต่อไปนี้:
- กลุ่มที่ 1: Ag + , Hg 2 2+ , Pb 2+ – รีเอเจนต์กลุ่ม 3M HCl;
- กลุ่มที่ 2: Hg 2+ , Cu 2+ , Cd 2+ , Bi 3+ , As 3+ , As 5+ , Sb 3+ , Sb 5+ , Sn 2+ , Sn 4+ – กลุ่มรีเอเจนต์ H 2 S ใน สภาพแวดล้อม 1M HCl;
- กลุ่ม 3: Ni 2+ , Co 2+ , Fe 2+ , Fe 3+ , Mn 2+ , Zn 2+ , Al 3+ , Cr 3+ – สารกลุ่ม (NH 4 ) 2 S ในสภาพแวดล้อมบัฟเฟอร์แอมโมเนียม;
- กลุ่มที่ 4: Ca 2+ , Sr 2+ , Ba 2+ – รีเอเจนต์กลุ่ม (NH 4 ) 2 CO 3 ในสภาพแวดล้อมบัฟเฟอร์แอมโมเนียม
- กลุ่มที่ 5: Mg 2+ , Na + , K + , NH 4 + – ไม่มีกลุ่มรีเอเจนต์
เมื่อเราแยกไอออนบวกบางกลุ่มออก เราสามารถระบุต่อไปได้โดยใช้รีเอเจนต์เพิ่มเติม คราวนี้เป็นไอออนที่มีลักษณะเฉพาะ ปฏิกิริยาดังกล่าวช่วยให้สามารถระบุตัวตนที่ชัดเจนได้ ตัวอย่างเช่น การตรวจจับไอออน Ag + ในตัวอย่างเกิดขึ้นในสองขั้นตอน:
- ปฏิกิริยากับกลุ่มรีเอเจนต์: การผลิตตะกอนสีขาว
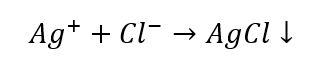
- ลักษณะเฉพาะของปฏิกิริยา: การละลายตะกอน AgCl ในสารละลายแอมโมเนียในน้ำ ทำให้ได้สารประกอบเชิงซ้อนที่ไม่มีสี
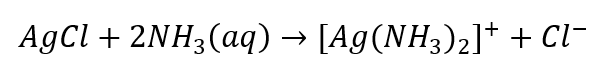
เราสามารถจำแนกแอนไอออนซึ่งแบ่งออกเป็นสามกลุ่มในลักษณะเดียวกัน:
- กลุ่มที่ 1: BO 2 – , CO 3 2- , C 2 O 4 2- , SiO 3 2- , PO 4 3- , AsO 3 3- , AsO 4 3- , SO 3 2- , S 2 O 3 2- , SO 4 2- , F – , CrO 4 2- , Cr 2 O 7 2- – รีเอเจนต์กลุ่ม BaCl 2 , การก่อตัวของเกลือที่ละลายได้น้อยในน้ำ;
- กลุ่มที่ 2: C 4 H 4 O 6 2- , S 2- , Cl – , ClO – , Br – , I – , CN – , SCN – – กลุ่มรีเอเจนต์ AgNO 3 การก่อตัวของเกลือที่ละลายได้น้อยในน้ำและเจือจาง กรดไนตริก
- กลุ่มที่ 3: CH 3 COO – , NO 2 – , NO 3 2- , ClO 3 – , ClO 4 – , MnO 4 – – รีเอเจนต์ของกลุ่มประกอบด้วยซิลเวอร์หรือแบเรียมไอออนบวก; การก่อตัวของเกลือที่ละลายน้ำได้
การจำแนกไอออนบวกค่อนข้างมีปัญหามากกว่าเมื่อเทียบกับแอนไอออน เนื่องจากลำดับของกระบวนการขึ้นอยู่กับผลลัพธ์ของปฏิกิริยากลุ่ม รวมทั้งมีไอออนที่รบกวนกระบวนการระบุไอออน ตัวอย่างเช่น เพื่อตรวจหา CO 3 2- ไอออน เราต้องทำปฏิกิริยาต่อไปนี้:
- ไอออนของ Ba 2+ ก่อให้เกิดตะกอนสีขาวที่ละลายได้ในกรด
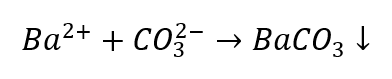
- กรดเจือจางทำให้เกิดการสลายตัวด้วยการตกตะกอนของ CO 2
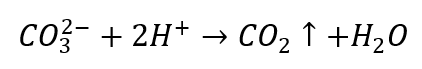
- คาร์บอนไดออกไซด์ทำให้สารละลายเกิดฟอง สามารถคลุมด้วยปูนขาวได้เนื่องจากตะกอนสีขาวจะตกตะกอน
* ไอออนรบกวน: SO 3 2- และ S 2 O 3 2- ยังก่อตัวเป็นตะกอนสีขาวด้วยแคลเซียมไอออนบวก พวกเขาจะต้องถูกออกซิไดซ์เพื่อกำจัดสิ่งรบกวน 
การวิเคราะห์เชิงคุณภาพ: เคมีอินทรีย์
การวิเคราะห์เชิงคุณภาพของ สารประกอบอินทรีย์ ประกอบด้วยหลายขั้นตอน และประเด็นสำคัญคือการแก้ปัญหาพื้นฐาน 5 ประการ:
- การวิเคราะห์พารามิเตอร์ทางกายภาพ เช่น จุดหลอมเหลวหรือจุดเดือด น่าเสียดายที่มีสารประกอบทางเคมีจำนวนมากที่มีจุดอุณหภูมิเดียวกัน และการวัดค่าเองอาจได้รับผลกระทบจากข้อผิดพลาด อย่างไรก็ตาม หากเรามีมาตรฐานอ้างอิงที่เหมาะสม วิธีนี้อาจช่วยให้เราระบุสารประกอบได้อย่างรวดเร็ว นอกจากนี้ การวัดอุณหภูมิทำให้เราสามารถระบุความบริสุทธิ์ของสารประกอบได้ เนื่องจากช่วงอุณหภูมิแคบ ความคงตัวของ T top หลังจากการตกผลึกอย่างน้อยหนึ่งครั้งยังอาจบ่งบอกถึงความบริสุทธิ์สูงของสารประกอบ สำหรับของเหลว อาจระบุช่วงการกลั่นที่แคบ
- การวิเคราะห์องค์ประกอบของธาตุ สามารถแยกหรือยืนยันการมีอยู่ของสารประกอบอินทรีย์บางประเภทได้ เพื่อยกตัวอย่าง โดยการยกเว้นการมีอยู่ของอะตอมของไนโตรเจนในโครงสร้าง เรายังไม่รวมการมีอยู่ของหมู่อะมิโนหรือไนตริก ด้วยเหตุนี้ เราจึงทำการทดลองในลักษณะต่างๆ เช่น การทดสอบของ Lassaigne สำหรับไนโตรเจน การทดสอบของ Beilstein สำหรับฮาโลเจน หรือการทดสอบกำมะถันโดยใช้โซเดียมไนโตรปรัสไซด์
- การทดสอบความสามารถในการละลายของสารประกอบ ทำให้เราสามารถจำแนกสารนั้นออกเป็นกลุ่มของสารประกอบที่มีคุณสมบัติทางเคมีตามที่ระบุ ตามหลักการ "ชอบละลายเหมือนกัน" สารประกอบถูกแบ่งออกเป็น 7 ประเภท
- การระบุหมู่ฟังก์ชัน จำเป็นต้องมีปฏิกิริยาวิเคราะห์ที่เหมาะสมซึ่งทำให้สามารถแยกหรือระบุหมู่ฟังก์ชันได้
- การวิเคราะห์สเปกตรัม เป็นจุดที่น่าเชื่อถือที่สุดซึ่งช่วยให้เราระบุสารประกอบทางเคมีได้อย่างชัดเจน ครอบคลุมเทคนิคการบรรเลงทั้งหมด เช่น:
- แมสสเปกโตรเมตรี (MS) ซึ่งประกอบด้วยการทำให้โมเลกุลแตกตัวเป็นไอออนและตรวจจับจำนวนไอออนโดยการกำหนดอัตราส่วนมวลต่อประจุ สิ่งนี้ช่วยให้เราสามารถสรุปผลเกี่ยวกับมวลของสารประกอบที่วิเคราะห์ได้
- สเปกโทรสโกปีด้วยคลื่นสนามแม่เหล็กนิวเคลียร์ (NMR) ซึ่งให้ข้อมูลเฉพาะเกี่ยวกับโครงสร้าง ให้ภาพของนิวเคลียสแม่เหล็ก ( 13 C, 1 H) ซึ่งทำให้สามารถตีความคุณภาพได้อย่างละเอียดถี่ถ้วน
- อินฟราเรด (IR) สเปกโทรสโกปี ใช้รังสีแม่เหล็กไฟฟ้าช่วงแคบเพื่อแสดงประเภทของการสั่นสะเทือนที่มีอยู่ในโมเลกุลที่ทดสอบ

