Sie ist einer der beiden Hauptzweige der analytischen Chemie und befasst sich mit dem Nachweis von chemischen Elementen, funktionellen Gruppen oder Ionen, die in der untersuchten Struktur vorhanden sind. Bezüglich der Methoden der qualitativen chemischen Analyse kann zwischen der klassischen und der instrumentellen Analyse unterschieden werden. Die klassische Analyse basiert auf Methoden, die auf chemischen Reaktionen beruhen, die auf "trockenem" oder "nassem" Weg ablaufen können. Die instrumentelle Analyse hingegen stützt sich auf Instrumente, d.h. analytische Messgeräte, deren Hauptelement der Detektor ist.

Klassische Analyse – trockene Reaktionen
Der Begriff „trockene“ Reaktionen bezieht sich auf die Veränderungen, die in chemischen Verbindungen auftreten, wenn sie bei hohen Temperaturen erhitzt werden. Es gibt drei Haupttypen solcher Reaktionen:
- Schmelzen der zu untersuchenden Probe mit festen Flussmitteln,
- Gewinnung von Borax- oder Phosphatperlen,
- Flammenfärbung des Gasbrenners.
Die am weitesten verbreitete Methode ist die dritte, der so genannte Flammentest, mit dem mehrere Elemente nachgewiesen werden können. Sie ist ein Beispiel für eine Technik, die das Phänomen der Strahlungsemission nutzt. Sie beruht auf der Untersuchung der charakteristischen Strahlung, die von den Atomen bestimmter Elemente ausgestrahlt wird, nachdem sie durch hohe Temperaturen angeregt worden sind. Es ist nämlich erwiesen, dass unter solchen Bedingungen Verbindungen bestimmter Metalle verdampfen und die dabei entstehenden Dämpfe angeregt werden und die Brennerflamme auf charakteristische Weise färben. Die Färbung ist das Ergebnis der Anregung von Elektronen bestimmter Atome, die bei der Rückkehr in ihren Grundzustand ein Lichtquant mit einer genau festgelegten Wellenlänge ausstrahlen. Die für bestimmte Elemente charakteristischen Färbungen der Flamme sind zum Beispiel:
- Natrium – intensiv gelb,
- Kalium-Violett,
- Kalzium – ziegelrot,
- Barium – grün,
- Bismut – blau.
Klassische Analyse – nasse Reaktionen
Dies sind alle Arten von Reaktionen, die zwischen untersuchten Proben und Lösungen verschiedener chemischer Reagenzien ablaufen. Um solche Reaktionen durchführen zu können, muss die untersuchte Substanz in eine Lösung umgewandelt werden. Die verwendeten Reaktionen werden nach mehreren Kriterien ausgewählt, so dass sie:
- eine hohe Empfindlichkeit aufweisen, so dass sie auch bei niedrigen Konzentrationen der nachgewiesenen Substanz auftreten,
- in kurzer Zeit auftreten und leicht zu beobachtende Veränderungen aufweisen, wie z.B. eine Veränderung der Farbe der Lösung, die Ausfällung eines Niederschlags oder die Entwicklung eines Gases,
- selektiv sind, d.h. dass sie nur innerhalb einer bekannten Gruppe von Ionen auftreten.

Qualitative Analyse – Anorganische Chemie
In der anorganischen Chemie konzentriert sich die qualitative Analytik auf zwei Themen: den Nachweis von Kationen und Anionen. Dabei werden charakteristische Reaktionen mit entsprechenden Gruppenreagenzien verwendet. Sie werden als Gruppenreagenzien bezeichnet, weil die Kationen in V Kategorien unterteilt sind. Ein solches Reagenz bildet jedoch nur mit einer dieser Kategorien einen Niederschlag, so dass es möglich ist, die in einer bestimmten Probe vorhandenen Kationenarten nach folgendem Schema einzugrenzen:
- Gruppe I: Ag+, Hg22+, Pb2+ – Gruppenreagenz 3M HCl;
- Gruppe II: Hg2+, Cu2+, Cd2+, Bi3+, As3+, As5+, Sb3+, Sb5+, Sn2+, Sn4+ – Gruppenreagenz H2S in der Umgebung 1M HCl;
- Gruppe III: Ni2+, Co2+, Fe2+, Fe3+, Mn2+, Zn2+, Al3+, Cr3+ – Gruppenreagenz (NH4)2S in der Umgebung eines Ammoniumpuffers;
- Gruppe IV: Ca2+, Sr2+, Ba2+ – Gruppenreagenz (NH4)2CO3 in der Umgebung eines Ammoniumpuffers;
- Gruppe V: Mg2+, Na+, K+, NH4+ – kein Gruppenreagenz.
Nach dem Ausschluss bestimmter Kationengruppen ist eine weitere Identifizierung mit weiteren Reagenzien möglich, die diesmal spezifisch für bestimmte Ionen sind. Die Durchführung einer solchen Reaktion ermöglicht eine eindeutige Identifizierung. Zum Beispiel ein Weg zum Nachweis von Ionen Ag+ in einer Probe sind zwei Etappen:
- Reaktion mit Gruppenreagenz – Bildung eines weißen Niederschlags
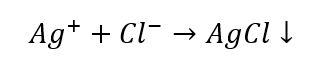
- Charakteristische Reaktion – Auflösung eines AgCl-Niederschlags in einer wässrigen Ammoniaklösung, wobei eine farblose Komplexverbindung entsteht
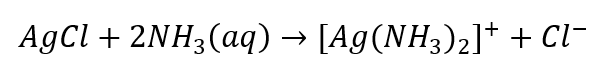
In ähnlicher Weise lassen sich Anionen identifizieren, die in drei Gruppen unterteilt sind:
- Gruppe I: BO2–, CO32-, C2O42-, SiO32-, PO43-, AsO33-, AsO43-, SO32-, S2O32-, SO42-, F–, CrO42-, Cr2O72- – Gruppenreagenz BaCl2, es bilden sich schwer wasserlösliche Salze;
- Gruppe II: C4H4O62-, S2-, Cl–, ClO–, Br–, I–, CN–, SCN– – Gruppenreagenz AgNO3, es entstehen in Wasser und verdünnter Salpetersäure schwer lösliche Salze;
- Gruppe III: CH3COO–, NO2–, NO32-, ClO3–, ClO4–, MnO4– – Gruppenreagenz enthält Silber- oder Bariumkationen, es bilden sich wasserlösliche Salze.
Die Identifizierung von Anionen ist im Vergleich zu Kationen etwas umständlicher, da die Reihenfolge des Vorgehens von den Ergebnissen der Gruppenreaktionen abhängt und es auch Ionen gibt, die bei der Identifizierung stören. Um zum Beispiel das CO32-Ion nachzuweisen, müssen folgende Reaktionen durchgeführt werden:
- Ionen Ba2+ verursachen die Bildung eines weißen Niederschlages, der in Säuren löslich ist
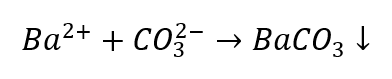
- Verdünnte Säuren verursachen eine Zersetzung unter Freisetzung von CO2
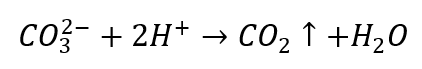
- Kohlendioxid bringt die Lösung zum Sprudeln. Es kann mit Kalkwasser nachgewiesen werden, da sich ein weißer Niederschlag absetzt.
* Störende Ionen: SO32-, S2O32- – bilden ebenfalls weiße Niederschläge mit dem Kalziumkation. Es ist notwendig, sie zu oxidieren, um die Störungen zu beseitigen.

Qualitative Analyse – Organische Chemie
Die qualitative Analyse organischer Verbindungen ist ein mehrstufiger Prozess, dessen Kernpunkt die Lösung von fünf grundlegenden Problemen ist:
- Bestimmung von physikalischen Parametern wie zum Beispiel dem Schmelz- oder Siedepunkt. Leider gibt es viele Verbindungen mit denselben charakteristischen Temperaturpunkten, und die Messung selbst kann mit Fehlern behaftet sein. Wenn man jedoch ein geeignetes Muster hat, kann diese Methode eine schnelle Identifizierung der Verbindung ermöglichen. Darüber hinaus ermöglicht die Messung von Temperaturen die Bestimmung der Reinheit der Verbindung, da diese einen engen Bereich haben. Die Unveränderlichkeit des Ttop-Wertes nach mindestens einer Kristallisation kann ebenfalls auf eine hohe Reinheit der Verbindung hindeuten. Für Flüssigkeiten – der enge Bereich der Destillationstemperaturen.
- Die Bestimmung der elementaren Zusammensetzung ermöglicht es, das Vorhandensein bestimmter Arten von organischen Verbindungen auszuschließen oder zu bestätigen. Durch den Ausschluss von Stickstoffatomen wird zum Beispiel das Vorhandensein von Amin- oder Nitrogruppen in der Struktur ausgeschlossen. Zu diesem Zweck werden charakteristische Versuche durchgeführt, wie der Lassaigne-Test für Stickstoff, der Beilstein-Test für Halogene oder der Schwefeltest mit Natriumnitroprussid.
- Die Untersuchung der Löslichkeit einer Verbindung ermöglicht es, sie in eine Gruppe von Verbindungen mit bestimmten chemischen Eigenschaften einzuordnen. Nach dem Prinzip „Gleiches löst sich in Gleichem“ werden die Gruppen von Verbindungen in 7 Kategorien unterteilt.
- Die Identifizierung funktioneller Gruppen erfordert entsprechende analytische Reaktionen, die den Ausschluss oder die Identifizierung funktioneller Gruppen ermöglichen.
- Die Spektralanalyse ist der maßgebliche Punkt, mit dem eine chemische Verbindung eindeutig identifiziert werden kann. Sie umfasst alle instrumentellen Techniken, wie z.B.:
- Massenspektrometrie (MS), bei der Moleküle ionisiert werden und die Anzahl der Ionen anhand ihres Masse-Ladungs-Verhältnisses bestimmt wird. Sie lässt Rückschlüsse bezüglich der Masse der untersuchten Verbindung zu.
- Kernspinresonanzspektroskopie (NMR), die detaillierte Informationen über die Struktur liefert. Sie liefert Bilder von magnetischen Kernen (13C, 1H), die eine genaue Interpretation ihrer Qualität ermöglichen.
- Infrarotspektroskopie (IR) nutzt einen schmalen Bereich elektromagnetischer Strahlung, um die Arten von Schwingungen im untersuchten Molekül aufzuzeigen.
