Es una de las dos divisiones principales de la química analítica, que se ocupa de la detección de elementos químicos, grupos funcionales o iones existentes en la estructura probada. En cuanto a los métodos utilizados, podemos dividir el análisis químico en análisis clásico y análisis instrumental. El análisis clásico se basa en métodos basados en reacciones químicas que pueden llevarse a cabo en modo "seco" o "húmedo". Por el contrario, el análisis instrumental se basa en instrumentos, es decir, instrumentos de medición analíticos, siendo el elemento principal el detector.

Análisis clásico: reacciones secas
El término “reacciones secas” se refiere a los cambios que ocurren en los compuestos químicos mientras se someten a altas temperaturas. Distinguimos tres tipos principales de tales reacciones:
- fundir la muestra analizada con fundentes sólidos,
- obtención de perlas de bórax o sal microcósmica,
- coloreando la llama del quemador de gas.
El más popular es el tercer método, que se conoce como prueba de llama y permite detectar muchos elementos. Este es un ejemplo de una técnica que utiliza la emisión de radiación. Consiste en examinar la radiación característica que emiten los átomos de elementos particulares una vez que son excitados por alta temperatura. Esto es así porque se ha demostrado que tales condiciones provocan la evaporación de los compuestos de ciertos metales, y los vapores producidos se excitan y colorean la llama del mechero de forma característica. El color es un efecto de la excitación de átomos particulares que, al ser restaurados a su estado original, emiten un cuanto de luz que se refiere a una longitud de onda específica. Por ejemplo, los colores de llama característicos de elementos particulares son los siguientes:
- sodio: amarillo intenso,
- potasio: violeta,
- calcio: rojo ladrillo,
- bario: verde,
- bismuto: azul claro.
Análisis clásico: reacciones húmedas
Estos son todos los tipos de reacciones que ocurren entre las muestras analizadas y las soluciones de varios reactivos químicos . Para llevar a cabo tales reacciones, la sustancia probada debe convertirse en una solución. Las reacciones aplicadas se seleccionan en base a muchos criterios, de modo que:
- muestran una alta sensibilidad, es decir, ya se producen a bajas concentraciones de la sustancia que se está detectando;
- ocurren en poco tiempo y muestran cambios fácilmente observables, como un cambio en el color de la solución, en la precipitación o en la emisión de gases;
- son selectivos, es decir, ocurren solo dentro de un grupo conocido de iones.

Análisis cualitativo: química inorgánica
En química inorgánica , el análisis cualitativo gira en torno a dos temas: la detección de cationes y aniones. La química inorgánica utiliza reacciones características que involucran reactivos de grupo apropiados. Se denominan “reactivos de grupo” porque los cationes se han dividido en cinco categorías. Tal reactivo forma sedimentos con uno solo de ellos, lo que permite reducir los tipos de cationes presentes en la muestra de acuerdo con el siguiente patrón:
- Grupo 1: Ag + , Hg 2 2+ , Pb 2+ – reactivo de grupo 3M HCl;
- Grupo 2: Hg 2+ , Cu 2+ , Cd 2+ , Bi 3+ , As 3+ , As 5+ , Sb 3+ , Sb 5+ , Sn 2+ , Sn 4+ – reactivo de grupo H 2 S en un Ambiente de HCl 1M;
- Grupo 3: Ni 2+ , Co 2+ , Fe 2+ , Fe 3+ , Mn 2+ , Zn 2+ , Al 3+ , Cr 3+ – reactivo de grupo (NH 4 ) 2 S en un ambiente tampón de amonio;
- Grupo 4: Ca 2+ , Sr 2+ , Ba 2+ – reactivo del grupo (NH 4 ) 2 CO 3 en ambiente tampón de amonio;
- Grupo 5: Mg 2+ , Na + , K + , NH 4 + – sin reactivo de grupo.
Una vez que excluimos ciertos grupos de cationes, podemos continuar la identificación con el uso de más reactivos, esta vez los que son característicos de iones particulares. Tal reacción permite una identificación inequívoca. Por ejemplo, la detección de iones Ag + en una muestra se produce en dos etapas:
- La reacción con un reactivo de grupo: producción de un sedimento blanco.
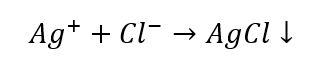
- La reacción característica: disolver el sedimento de AgCl en una solución acuosa de amoníaco, obteniendo un compuesto complejo incoloro.
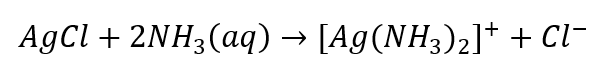
Podemos identificar los aniones, que se dividen en tres grupos, de manera similar:
- Grupo 1: BO 2 – , CO 3 2- , C 2 O 4 2- , SiO 3 2- , PO 4 3- , AsO 3 3- , AsO 4 3- , SO 3 2- , S 2 O 3 2- , SO 4 2- , F – , CrO 4 2- , Cr 2 O 7 2- – reactivo de grupo BaCl 2 , la formación de sales poco solubles en agua;
- Grupo 2: C 4 H 4 O 6 2- , S 2- , Cl – , ClO – , Br – , I – , CN – , SCN – – grupo reactivo AgNO 3 , la formación de sales poco solubles en agua y en agua diluida Ácido nítrico;
- Grupo 3: CH 3 COO – , NO 2 – , NO 3 2- , ClO 3 – , ClO 4 – , MnO 4 – – el reactivo del grupo contiene cationes de plata o bario; la formación de sales solubles en agua.
La identificación de cationes es algo más problemática en comparación con los aniones, ya que la secuencia de procedimientos depende de los resultados de las reacciones del grupo, además hay iones que perturban el proceso de identificación. Por ejemplo, para detectar un ion CO 3 2- tenemos que realizar las siguientes reacciones:
- Los iones Ba 2+ producen un sedimento blanco que es soluble en ácidos
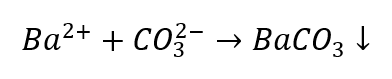
- Los ácidos diluidos causan descomposición con precipitación de CO 2
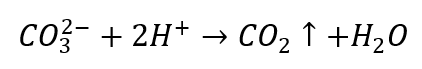
- El dióxido de carbono hace que la solución burbujee. Se puede cubrir con agua de cal, ya que el sedimento blanco se precipitará.
* Iones perturbadores: SO 3 2- y S 2 O 3 2- también forman sedimentos blancos con el catión calcio. Deben oxidarse para eliminar la perturbación. 
Análisis cualitativo: química orgánica
El análisis cualitativo de compuestos orgánicos incluye múltiples etapas, y el punto clave es resolver cinco cuestiones fundamentales:
- Ensayo de parámetros físicos como el punto de fusión o ebullición. Desafortunadamente, hay muchos compuestos químicos con los mismos puntos de temperatura y la medición en sí puede verse afectada por errores. Sin embargo, si tenemos un estándar de referencia apropiado, este método puede permitirnos identificar rápidamente el compuesto. Además, midiendo las temperaturas podemos determinar la pureza del compuesto, ya que los rangos de temperatura son estrechos. La constancia de T top después de al menos una cristalización también puede sugerir una alta pureza del compuesto. Para líquidos, puede indicar un rango de destilación estrecho.
- El ensayo de la composición elemental puede excluir o confirmar la presencia de tipos particulares de compuestos orgánicos. Para dar un ejemplo, al excluir la presencia de átomos de nitrógeno en la estructura, también excluimos la presencia de grupos amino o nítricos. Para ello realizamos experimentos característicos como el test de Lassaigne para nitrógeno, el test de Beilstein para halógenos o el test de azufre con nitroprusiato de sodio.
- Probar la solubilidad del compuesto nos permite clasificarlo en el grupo de compuestos con propiedades químicas específicas. De acuerdo con el principio de “lo similar se disuelve”, los compuestos se han dividido en 7 categorías.
- La identificación de grupos funcionales requiere reacciones analíticas apropiadas que permitan excluir o identificar grupos funcionales.
- El análisis espectral es el punto más fiable que nos permite identificar claramente un compuesto químico. Abarca todas las técnicas instrumentales, tales como:
- Espectrometría de masas (MS) , que consiste en ionizar las moléculas y detectar el número de iones mediante la determinación de su relación masa-carga. Esto nos permite sacar conclusiones sobre la masa del compuesto analizado;
- Espectroscopia de resonancia magnética nuclear (RMN) , que proporciona información específica sobre la estructura. Proporciona una imagen de los núcleos magnéticos ( 13 C, 1 H), lo que permite una interpretación completa de su calidad;
- La espectroscopia infrarroja (IR) utiliza un rango estrecho de radiación electromagnética para mostrar los tipos de vibraciones existentes en la molécula analizada.

