È una delle due principali divisioni della chimica analitica, che si occupa di rilevare elementi chimici, gruppi funzionali o ioni esistenti nella struttura testata. In termini di metodi utilizzati, possiamo dividere l'analisi chimica in analisi classica e analisi strumentale. L'analisi classica si basa su metodi basati su reazioni chimiche che possono essere effettuate in modalità "secco" o "umido". Al contrario, l'analisi strumentale si basa su strumenti, cioè strumenti di misura analitici con l'elemento principale che è il rivelatore.

Analisi classica: reazioni a secco
Il termine "reazioni secche" si riferisce ai cambiamenti che si verificano nei composti chimici mentre sono sottoposti a temperature elevate. Distinguiamo tre tipi principali di tali reazioni:
- fusione del campione testato con flussi solidi,
- ottenere borace o perline di sale microcosmico,
- colorare la fiamma del bruciatore a gas.
Il più diffuso è il terzo metodo, denominato test della fiamma, che consente di rilevare molti elementi. Questo è un esempio di una tecnica che utilizza l’emissione di radiazioni. Consiste nell’esaminare la radiazione caratteristica che viene emessa dagli atomi di particolari elementi una volta eccitati dall’alta temperatura. Questo in quanto è stato dimostrato che tali condizioni provocano l’evaporazione dei composti di alcuni metalli, ed i vapori prodotti vengono eccitati e colorano in modo caratteristico la fiamma del bruciatore. Il colore è un effetto dell’eccitazione di particolari atomi che, pur essendo riportati al loro stato originario, emettono un quanto di luce che si riferisce ad una determinata lunghezza d’onda. Ad esempio, i colori della fiamma caratteristici di particolari elementi sono i seguenti:
- sodio: giallo intenso,
- potassio: viola,
- calcio: rosso mattone,
- bario: verde,
- bismuto: azzurro.
Analisi classica: reazioni umide
Questi sono tutti i tipi di reazioni che si verificano tra i campioni testati e le soluzioni di vari reagenti chimici . Per eseguire tali reazioni, la sostanza testata deve essere convertita in una soluzione. Le reazioni applicate sono selezionate in base a molti criteri, in modo che:
- mostrano elevata sensibilità, cioè si verificano già a basse concentrazioni della sostanza rilevata;
- si verificano in breve tempo e mostrano cambiamenti facilmente osservabili come un cambiamento nel colore della soluzione, nella precipitazione o nell’emissione di gas;
- sono selettivi, cioè si verificano solo all’interno di un gruppo noto di ioni.

Analisi qualitativa: chimica inorganica
Nella chimica inorganica , l’analisi qualitativa ruota attorno a due argomenti: la rilevazione di cationi e anioni. La chimica inorganica utilizza reazioni caratteristiche che coinvolgono reagenti di gruppo appropriati. Sono chiamati “reattivi di gruppo” perché i cationi sono stati divisi in cinque categorie. Tale reagente forma sedimenti con uno solo di essi, il che consente di restringere i tipi di cationi presenti nel campione secondo il seguente schema:
- Gruppo 1: Ag + , Hg 2 2+ , Pb 2+ – reagente di gruppo 3M HCl;
- Gruppo 2: Hg 2+ , Cu 2+ , Cd 2+ , Bi 3+ , As 3+ , As 5+ , Sb 3+ , Sb 5+ , Sn 2+ , Sn 4+ – reagente di gruppo H 2 S in un ambiente HCl 1M;
- Gruppo 3: Ni 2+ , Co 2+ , Fe 2+ , Fe 3+ , Mn 2+ , Zn 2+ , Al 3+ , Cr 3+ – reagente di gruppo (NH 4 ) 2 S in ambiente tampone ammonio;
- Gruppo 4: Ca 2+ , Sr 2+ , Ba 2+ – reagente di gruppo (NH 4 ) 2 CO 3 in ambiente tampone ammonio;
- Gruppo 5: Mg 2+ , Na + , K + , NH 4 + – nessun reagente di gruppo.
Una volta esclusi alcuni gruppi di cationi, possiamo continuare l’identificazione con l’uso di ulteriori reagenti, questa volta caratteristici di particolari ioni. Tale reazione consente un’identificazione univoca. Ad esempio, il rilevamento degli ioni Ag + in un campione avviene in due fasi:
- La reazione con un reagente di gruppo: produzione di un sedimento bianco
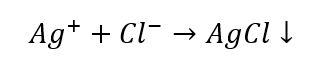
- La reazione caratteristica: sciogliere il sedimento di AgCl in una soluzione acquosa di ammoniaca, ottenendo un composto complesso incolore.
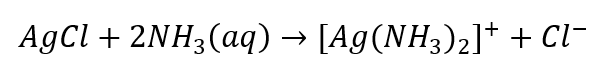
Possiamo identificare gli anioni, che sono divisi in tre gruppi, in modo simile:
- Gruppo 1: BO 2 – , CO 3 2- , C 2 O 4 2- , SiO 3 2- , PO 4 3- , AsO 3 3- , AsO 4 3- , SO 3 2- , S 2 O 3 2- , SO 4 2- , F – , CrO 4 2- , Cr 2 O 7 2- – reagente di gruppo BaCl 2 , formazione di sali scarsamente solubili in acqua;
- Gruppo 2: C 4 H 4 O 6 2- , S 2- , Cl – , ClO – , Br – , I – , CN – , SCN – – reagente di gruppo AgNO 3 , la formazione di sali scarsamente solubili in acqua e in diluito l’acido nitrico;
- Gruppo 3: CH 3 COO – , NO 2 – , NO 3 2- , ClO 3 – , ClO 4 – , MnO 4 – – il reagente di gruppo contiene cationi di argento o bario; formazione di sali idrosolubili.
L’identificazione dei cationi è in qualche modo più problematica rispetto agli anioni, poiché la sequenza delle procedure dipende dai risultati delle reazioni di gruppo, inoltre ci sono ioni che disturbano il processo di identificazione. Ad esempio, per rilevare uno ione CO 3 2- dobbiamo condurre le seguenti reazioni:
- Gli ioni Ba 2+ producono un sedimento bianco solubile negli acidi
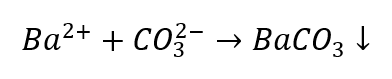
- Gli acidi diluiti causano la decomposizione con precipitazione di CO 2
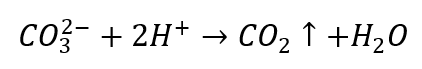
- L’anidride carbonica fa bollire la soluzione. Può essere coperto con acqua di calce, poiché il sedimento bianco precipiterà.
* Ioni di disturbo: SO 3 2- e S 2 O 3 2- formano anch’essi sedimenti bianchi con il catione di calcio. Devono essere ossidati per eliminare il disturbo. 
Analisi qualitativa: chimica organica
L’analisi qualitativa dei composti organici comprende più fasi e il punto chiave è risolvere cinque problemi fondamentali:
- Saggio di parametri fisici come il punto di fusione o di ebollizione. Sfortunatamente, ci sono molti composti chimici con gli stessi punti di temperatura e la misurazione stessa può essere influenzata da errori. Tuttavia, se disponiamo di uno standard di riferimento appropriato, questo metodo può consentirci di identificare rapidamente il composto. Inoltre, misurando le temperature possiamo determinare la purezza del composto, poiché gli intervalli di temperatura sono ristretti. Anche la costanza di T top dopo almeno una cristallizzazione può suggerire un’elevata purezza del composto. Per i liquidi, può indicare un intervallo di distillazione ristretto.
- Il dosaggio della composizione elementare può escludere o confermare la presenza di particolari tipi di composti organici. Per fare un esempio, escludendo la presenza di atomi di azoto nella struttura, escludiamo anche la presenza di gruppi amminici o nitrici. A tal fine, eseguiamo esperimenti caratteristici come il test di Lassaigne per l’azoto, il test di Beilstein per gli alogeni o il test dello zolfo con nitroprussiato di sodio.
- Testare la solubilità del composto ci consente di classificarlo nel gruppo di composti con proprietà chimiche specificate. Secondo il principio “il simile dissolve il simile”, i composti sono stati suddivisi in 7 categorie.
- L’identificazione dei gruppi funzionali richiede opportune reazioni analitiche che consentano di escludere o identificare i gruppi funzionali.
- L’analisi spettrale è il punto più affidabile che ci consente di identificare chiaramente un composto chimico. Copre tutte le tecniche strumentali, come:
- Spettrometria di massa (MS) , che consiste nel ionizzare le molecole e rilevare il numero di ioni determinandone il rapporto massa-carica. Questo ci permette di trarre conclusioni sulla massa del composto analizzato;
- Spettroscopia di risonanza magnetica nucleare (NMR) , che fornisce informazioni specifiche sulla struttura. Fornisce un’immagine dei nuclei magnetici ( 13 C, 1 H), che consente un’interpretazione completa della loro qualità;
- La spettroscopia a infrarossi (IR) utilizza una gamma ristretta di radiazioni elettromagnetiche per mostrare i tipi di vibrazioni esistenti nella molecola testata.

