Jest jednym z dwóch głównych działów chemii analitycznej, zajmującym się wykrywaniem obecnych w badanej strukturze pierwiastków chemicznych, grup funkcyjnych lub jonów. Ze względu na metody wykorzystywane w jakościowej analizie chemicznej możliwy jest podział na analizę klasyczną oraz instrumentalną. Analiza klasyczna bazuje na metodach opartych o reakcje chemiczne, które mogą przebiegać na drodze „suchej” lub mokrej”. Analiza instrumentalna opiera się natomiast na instrumentach, czyli analitycznych przyrządach pomiarowych, których głównym elementem jest detektor.

Analiza klasyczna – reakcje na drodze suchej
Termin reakcji „suchych” odnosi się do zmian, które zachodzą w związkach chemicznych w trakcie ogrzewania ich, w wysokich temperaturach. Wyróżnia się trzy zasadnicze typy takich reakcji:
- stapianie badanej próbki ze stałymi topnikami,
- otrzymywanie pereł boraksowych lub fosforanowych,
- barwienie płomienia palnika gazowego.
Najpowszechniej używana jest metoda trzecia, nazywana próbą płomienia, pozwalająca na detekcję wielu pierwiastków. Jest to przykład techniki, która wykorzystuje zjawisko emisji promieniowania. Polega na badaniu charakterystycznego promieniowania, które jest emitowane przez atomy konkretnych pierwiastków po uprzednim ich wzbudzeniu w wyniku działania wysokiej temperatury. Udowodniono bowiem, że w takich warunkach dochodzi do wyparowania związków niektórych metali, a powstałe pary zostają pobudzone i zabarwiają płomień palinka w charakterystyczny sposób. Barwa jest efektem wzbudzenia elektronów konkretnych atomów, które w trakcie powrotu do swojego podstawowego stanu emitują kwant światła, odnoszący się do ściśle określonej długości fali. Dla przykładu, zabarwienia płomienia charakterystyczne dla konkretnych pierwiastków to:
- sód – intensywny żółty,
- potas – fiołkowy,
- wapń – ceglasty,
- bar – zielony,
- bizmut – błękitny.
Analiza klasyczna – reakcje na drodze mokrej
Są to wszelkiego rodzaju reakcje, które zachodzą pomiędzy badanymi próbkami oraz roztworami różnorodnych odczynników chemicznych. W celu przeprowadzenia takich reakcji, substancja testowana musi zostać przeprowadzona w roztwór. Wykorzystywane reakcje dobiera się według kilku kryteriów, tak aby:
- Posiadały dużą czułość, a więc zachodziły już przy małych stężeniach wykrywanej substancji.
- Zachodziły w krótkim czasie oraz wykazywały zmiany łatwe do obserwacji, takie jak zmiana zabarwienia roztworu, strącenie osadu lub wydzielenie gazu.
- Były selektywne, czyli zachodziły jedynie w obrębie znanej grupy jonów.

Analiza jakościowa – chemia nieorganiczna
W chemii nieorganicznej, analityka jakościowa skupia się wokół dwóch tematów – wykrywania kationów oraz anionów. Wykorzystywane są tutaj reakcje charakterystyczne z użyciem odpowiednich odczynników grupowych. Nazywa się je grupowymi, ponieważ kationy zostały podzielone na V kategorii. Taki odczynnik tworzy natomiast osady jedynie z jedną z nich, przez co możliwe jest zawężenie rodzajów kationów obecnych w danej próbce, według schematu:
- Grupa I: Ag+, Hg22+, Pb2+ – odczynnik grupowy 3M HCl;
- Grupa II: Hg2+, Cu2+, Cd2+, Bi3+, As3+, As5+, Sb3+, Sb5+, Sn2+, Sn4+ – dczynnik grupowy H2S w środowisku 1M HCl;
- Grupa III: Ni2+, Co2+, Fe2+, Fe3+, Mn2+, Zn2+, Al3+, Cr3+ – odczynnik grupowy (NH4)2S w środowisku buforu amonowego;
- Grupa IV: Ca2+, Sr2+, Ba2+ – odczynnik grupowy (NH4)2CO3 w środowisku buforu amonowego;
- Grupa V: Mg2+, Na+, K+, NH4+ – brak odczynnika grupowego.
Po wykluczeniu pewnych grup kationów możliwa jest dalsza jego identyfikacja przy zastosowaniu kolejnych odczynników, tym razem charakterystycznych dla konkretnych jonów. Przeprowadzenie takiej reakcji pozwala na jednoznaczną identyfikację. Na przykład, drogą do wykrycia w próbce jonów Ag+ są dwa etapy:
- Reakcja z odczynnikiem grupowym – wytworzenie białego osadu
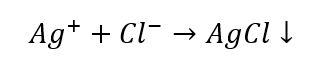
- Reakcja charakterystyczna – rozpuszczanie osadu AgCl w wodnym roztworze amoniaku, otrzymanie bezbarwnego związku kompleksowego
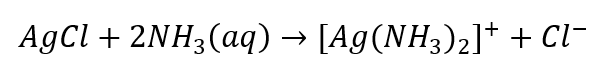
Podobnie możliwa jest identyfikacja anionów, podzielonych na trzy grupy:
- Grupa I: BO2–, CO32-, C2O42-, SiO32-, PO43-, AsO33-, AsO43-, SO32-, S2O32-, SO42-, F–, CrO42-, Cr2O72- – odczynnik grupowy BaCl2, powstają sole trudno rozpuszczalne w wodzie;
- Grupa II: C4H4O62-, S2-, Cl–, ClO–, Br–, I–, CN–, SCN– – odczynnik grupowy AgNO3, powstają sole trudno rozpuszczalne w wodzie i w rozcieńczonym kwasie azotowym;
- Grupa III: CH3COO–, NO2–, NO32-, ClO3–, ClO4–, MnO4– – odczynnik grupowy zawiera kationy srebra lub baru, powstają rozpuszczalne w wodzie sole.
Identyfikacja anionów jest nieco bardziej kłopotliwa w porównaniu do kationów, gdyż kolejność postępowania uzależniona jest od wyników reakcji grupowych, istnieją również jony przeszkadzające w identyfikacji. Dla przykładu, w celu wykrycia jonu CO32- należy przeprowadzić reakcje:
- Jony Ba2+ powodują powstanie białego osadu, rozpuszczalnego w kwasach
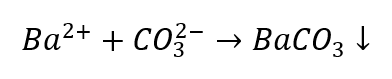
- Rozcieńczone kwasy powodują rozkład z wydzieleniem CO2
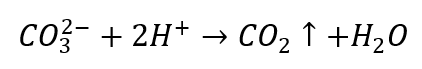
- Dwutlenek węgla powoduje bąbelkowanie roztworu. Można go wykryć przy pomocy wody wapiennej, gdyż wytrąci się biały osad.
* Jony przeszkadzające: SO32-, S2O32- – również tworzą białe osady z kationem wapnia. Konieczne jest ich utlenienie w celu wyeliminowania zakłócenia.

Analiza jakościowa – chemia organiczna
Analiza jakościowa związków organicznych jest wieloetapowa, a kluczowym punktem jest rozwiązanie pięciu podstawowych problemów:
- Oznaczenie parametrów fizycznych, takich jak temperatura topnienia lub wrzenia. Niestety, istnieje wiele związków o tych samych charakterystycznych punktach temperaturowych, a sam pomiar może być obarczony błędem. Jeżeli jednak posiadamy odpowiedni wzorzec – ta metoda może pozwolić na szybką identyfikację związku. Ponadto, pomiar temperatur pozwala na określenie czystości związku, gdyż posiadają one wąski zakres. Niezmienność Ttop po przynajmniej jednej krystalizacji również może sugerować wysoką czystość związku. W przypadku cieczy – wąski zakres temperatury destylacji.
- Oznaczenie składu pierwiastkowego pozwala na wykluczenie lub potwierdzenie obecności konkretnych typów związków organicznych. Dla przykładu, wykluczając obecność atomów azotu wyklucza się obecność w strukturze grup aminowych czy nitrowych. W tym celu wykonuje się doświadczenia charakterystyczne, takie jak próba Lassaigne’a na azot, próba Beilsteina na fluorowce czy też próba na siarkę z użyciem nitroprusydku sodu.
- Badanie rozpuszczalności związku pozwala na jego zakwalifikowanie do grupy związków o określonych właściwościach chemicznych. W myśl zasady „podobne rozpuszcza się w podobnym”, podzielono grupy związków na 7 kategorii.
- Identyfikacja grup funkcyjnych wymaga przeprowadzenia odpowiednich reakcji analitycznych, które pozwalają na wykluczenie lub identyfikację grup funkcyjnych.
- Analiza spektralna stanowi najbardziej miarodajny punkt, dzięki któremu możliwe jest jednoznaczne zidentyfikowanie związku chemicznego. Obejmuje wszystkie techniki instrumentalne, takie jak:
- Spektrometria mas (MS), polegająca na jonizacji cząsteczek oraz detekcji liczby jonów w postaci ich stosunku masy do ładunku. Pozwala na wnioskowanie na temat masy analizowanego związku;
- Spektroskopia magnetycznego rezonansu jądrowego (NMR), dostarczająca szczegółowych informacji na temat struktury. Dostarcza obraz jąder magnetycznych (13C, 1H), pozwalający na dokładną interpretację ich jakości;
- Spektroskopia w podczerwieni (IR), wykorzystuje wąski zakres promieniowania elektromagnetycznego do ukazania rodzajów drgań występujących w badanej cząsteczce.
