Le micelle sono ammassi microscopici di molecole caratterizzati da una struttura sferica. Sono un gruppo di composti tensioattivi, ovvero tensioattivi, comunemente utilizzati e molto efficaci. Grazie alle loro proprietà uniche, svolgono un ruolo molto importante in molti settori, tra cui la cosmetologia.

Grazie alla loro struttura, le micelle assorbono praticamente ogni tipo di impurità dalla superficie su cui vengono applicate. Le micelle sono spesso menzionate nel contesto dei cosmetici per la pulizia del viso, ma sono anche ingredienti di prodotti come detersivi per il bucato e detersivi per i piatti. Le soluzioni micellari sono caratterizzate dalla loro capacità di sciogliere composti scarsamente solubili, che è la definizione del processo di solubilizzazione.
Struttura e proprietà delle micelle
La struttura delle micelle determina le loro proprietà fisico-chimiche uniche. In questa sezione, esamineremo come si formano le micelle, di cosa sono composte e quali processi determinano il loro comportamento in soluzione.
Attraverso gli occhi di un chimico
Le micelle non sono altro che colloidi associativi formati a seguito del processo di micellizzazione . Questo processo si riferisce alla trasformazione di molecole o ioni anfifilici che, a seguito della dissoluzione, subiscono un’autoassociazione in cluster più grandi. Le micelle non sono quindi un gruppo specifico di composti chimici, ma piuttosto una forma specifica di organizzazione delle loro molecole. Questa trasformazione spontanea che porta alla formazione di micelle è caratteristica di varie sostanze organiche le cui molecole sono composte da due parti con polarità significativamente diverse. Quando il contenuto di tensioattivi in una soluzione aumenta, a una certa concentrazione di associati, queste strutture caratteristiche iniziano a formarsi. Il punto di partenza per tali trasformazioni è chiamato concentrazione di CMC.
Cosa significa CMC?
La CMC, o concentrazione critica di micellizzazione , è la concentrazione alla quale le micelle iniziano a formarsi a seguito dell’autotrasformazione dei monomeri accumulati in aggregati più grandi . Questa formazione di cluster di molecole è accompagnata anche da un cambiamento nelle loro proprietà fisiche.
Al di sopra della CMC, tale gruppo di molecole rimane in equilibrio con le singole molecole, diventando così una forma termodinamicamente stabile. Questo equilibrio è un punto chiave di transizione, poiché può procedere continuamente in entrambe le direzioni. Ad esempio, durante la diluizione, le micelle si scompongono nuovamente. Al di sotto della concentrazione CNC, le molecole di tensioattivo si muovono liberamente nella soluzione senza alcuna struttura organizzata.
Proprietà fisiche delle micelle
Quando la concentrazione del tensioattivo nella soluzione aumenta, si verificano i seguenti cambiamenti:
- Tensione superficiale,
- Conduttività elettrica,
- Intensità di diffusione della luce,
- Viscosità.
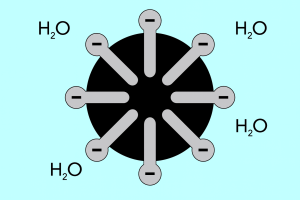
Testa e coda – struttura delle micelle
La struttura delle micelle può essere divisa in due parti principali, che differiscono significativamente per polarità e sono chiamate:
- Testa idrofila , che ha un’elevata affinità per l’acqua. È la parte della micella responsabile della tendenza delle particelle a combinarsi con l’acqua, ma anche a respingere i grassi.
- La coda idrofobica , nota anche come coda lipofila, ha l’effetto opposto: attrae le molecole verso i grassi e respinge l’acqua.
L’area idrofobica è costituita più spesso da catene di idrocarburi, radicali:
- alchile,
- alchilarile,
- radicali di idrocarburi fluorurati.
L’area idrofila è costituita da gruppi che interagiscono con l’acqua in modo sufficientemente forte, come i gruppi ionogeni. Anche i gruppi non ionici, come i gruppi eterei, possono far parte dell’area idrofila delle micelle, ma questo di solito richiede la presenza di un numero maggiore di gruppi polari nella molecola.
Il processo di micellizzazione
Poiché la parte non polare della sostanza, ad esempio la catena alchilica di una singola molecola di tensioattivo dispersa, ha un’ampia superficie a contatto con l’acqua e l’interazione tra diverse molecole d’acqua è molto più forte della loro interazione con i gruppi –CH2 presenti nella catena, l’entropia del sistema diminuisce e le molecole d’acqua iniziano a organizzarsi nel sito della catena alchilica.
Ciò provoca una sorta di spostamento delle catene idrocarburiche dall’interno della fase acquosa. All’aumentare della concentrazione del tensioattivo, aumenta anche il numero di collisioni tra di esse. Ciò aumenta anche la probabilità di aggregazione e ispessimento delle molecole.
La condensazione delle molecole è accompagnata da una diminuzione dell’entalpia libera. Questo è anche il risultato della combinazione di residui non polari con un nucleo non polare allo stato liquido, separato dalla fase acquosa da gruppi polari.
Una volta raggiunta la suddetta concentrazione di CMC, ovvero la concentrazione critica delle micelle, si accumulano cluster sferici, in cui i gruppi polari delle singole particelle sono diretti verso la fase acquosa, mentre le catene idrocarburiche non polari formano l’interno. Le micelle così formate sono chiamate micelle normali.
Nei solventi organici possono formarsi micelle inverse, in cui la parte idrofobica si trova all’esterno.

Tipi ed esempi di tensioattivi
Il tipo di tensioattivi utilizzati per formare le micelle ha un impatto enorme sulla loro struttura e funzionalità. Di seguito sono riportati i tipi e gli esempi più comuni di tensioattivi che formano le micelle
Esempi di ioni tensioattivi
Ioni caricati negativamente, cationi:
- carbossilato,
- solfato,
- solfonato,
- fosfato.
Ioni caricati positivamente, cationi:
- ammonio,
- fosfonio.
Tipi di tensioattivi
- Tensioattivi ionici
- Anionici, ad esempio SDS, o dodecilsolfato di sodio,
- Cationico, ad esempio CTAB, o bromuro di cetiltrimetilammonio,
- Anfioni, cioè ioni detti anfifilici o bipolari, che hanno sia un gruppo cationico caricato positivamente sia un gruppo anionico caricato negativamente, ad esempio la Lecitina, cioè la Fosfatidilolina.
- Tensioattivi non ionici, ad esempio poliossietilene.
Attività superficiale dei tensioattivi e struttura micellare
Questo parametro, caratteristico dei composti tensioattivi, aumenta con il numero di gruppi metilenici presenti nella catena idrocarburica.
A causa della struttura della catena, le micelle possono essere suddivise in:
- Catena singola
- Anionico, ad esempio SDS,
- Cationico, ad esempio CTAB.
- Doppia catena
- Anionico, ad esempio AOT, cioè bis(2-etilesil) succinatosolfonato di sodio,
- Cationico, ad esempio bromuro di diesadecildimetilammonio.
- Molecolare, ad esempio MGDG, cioè monogalattosil digliceride.

Applicazione di micelle
Le micelle hanno una vasta gamma di applicazioni, dalla cosmetologia all’industria farmaceutica e chimica. Scopri i settori più importanti in cui le loro proprietà vengono utilizzate nella pratica.
Pulizia efficace della pelle
Ciò è possibile grazie alla presenza di particelle sia lipofile che idrofile. Ad esempio, negli struccanti contenenti acqua micellare, le particelle idrofobiche si legano al sebo e ai residui di trucco sulla pelle, mentre le particelle idrofile attraggono polvere e sporco. Ciò si traduce in un doppio effetto detergente, consentendo una detersione efficace e profonda senza seccare o irritare inutilmente la pelle.
I prodotti micellari sono consigliati anche per le pelli sensibili grazie alla loro azione delicata. Non è necessario strofinare o premere con forza con dischetti di cotone e l’azione di questi colloidi è paragonabile a quella di una calamita sullo sporco. Le soluzioni acquose con micelle non alterano lo strato idrolipidico dell’epidermide.
Formulazione di cosmetici micellari
Un altro vantaggio delle micelle, che sono particelle molto piccole, è che non ci sono restrizioni sulle formulazioni in cui possono essere utilizzate. Possono essere utilizzate nella loro forma più popolare – l’acqua micellare – ma anche in creme e lozioni.
Sono disponibili anche formule in gel altamente concentrate, che non richiedono l’uso di asciugamani o dischetti di cotone, ma devono solo essere massaggiate sulla pelle e risciacquate con acqua.
Azione in tre fasi delle micelle
- Attrazione delle impurità grazie alle code idrofobiche,
- Incapsulamento , che intrappola le molecole di grasso e sporco all’interno delle micelle,
- Rimozione delle impurità intrappolate nelle micelle attraverso teste idrofile che rimangono a contatto con la fase acquosa.
Altre applicazioni industriali delle micelle
- Cosmetologia , principalmente liquidi micellari e lozioni struccanti, ma anche shampoo micellari per la pulizia profonda del cuoio capelluto e gel doccia.
- Farmacia , ad esempio per aumentare la biodisponibilità dei principi attivi introducendo nell’organismo farmaci con solubilità limitata sotto forma di soluzioni micellari non ioniche.
- Prodotti per la pulizia : il processo di solubilizzazione sopra menzionato spiega la fisico-chimica del lavaggio. I colloidi micellari sotto forma di soluzioni circondano il grasso, separano lo sporco e lo rimuovono dai tessuti. Quando si utilizzano tensioattivi ionici, le particelle di sporco e la superficie a cui aderiscono acquisiscono la stessa carica, rendendole facili da separare l’una dall’altra.
- Processi fisici e chimici : catalisi micellare, inibizione delle reazioni chimiche, processi di flottazione e recupero dell’olio.
- Witek K. Synteza, właściwości powierzchniowe i zastosowanie surfaktantów amfoterycznych, zawierających ugrupowania labilne, Politechnika Wrocławska 2022
- K.Michocka Otrzymywanie i właściwości użytkowe nowych surfaktantów z ugrupowaniem cukrowym, Uniwersytet Ekonomiczny w Poznaniu 2012
- A.Piotrowska-Kirschling, J.Drzeżdżon, L.Chmurzyński, D.Jacewicz Krytyczne stężenie micelarne i metody jego wyznaczania, Wiadomości chemiczne 2018
- https://wydawnictwo.ue.poznan.pl/books/978-83-8211-090-6/sample.pdf
- https://home.agh.edu.pl/~nmos1/FUK/fizykochemia_powierzchni_skany/15/dutkiewicz_15.pdf
- https://phavi.umcs.pl/at/attachments/2018/0608/143246-chemia-koloidow-cwiczenie-1.pdf
























































































































