Les micelles sont des amas microscopiques de molécules à structure sphérique. Elles constituent un groupe de tensioactifs (ou tensioactifs) couramment utilisés et très efficaces. Grâce à leurs propriétés uniques, elles jouent un rôle crucial dans de nombreux secteurs, dont la cosmétologie.

Grâce à leur structure, les micelles absorbent pratiquement toutes les impuretés de la surface sur laquelle elles sont appliquées. Les micelles sont le plus souvent utilisées dans les cosmétiques nettoyants pour le visage, mais elles entrent également dans la composition de produits tels que les lessives et les liquides vaisselle. Les solutions micellaires se caractérisent par leur capacité à dissoudre les composés peu solubles, ce qui définit le processus de solubilisation.
Structure et propriétés des micelles
La structure des micelles détermine leurs propriétés physicochimiques uniques. Dans cette section, nous examinerons comment les micelles se forment, de quoi elles sont composées et quels processus déterminent leur comportement en solution.
À travers les yeux d’un chimiste
Les micelles ne sont rien d’autre que des colloïdes associatifs formés par le processus de micellisation . Ce processus désigne la transformation de molécules ou d’ions amphiphiles qui, par dissolution, s’auto-associent en agrégats plus importants. Les micelles ne constituent donc pas un groupe spécifique de composés chimiques, mais plutôt une forme spécifique d’organisation de leurs molécules. Cette transformation spontanée conduisant à la formation de micelles est caractéristique de diverses substances organiques dont les molécules sont composées de deux parties de polarités sensiblement différentes. Lorsque la teneur en tensioactifs d’une solution augmente, à partir d’une certaine concentration en micelles, ces structures caractéristiques commencent à se former. Le point de départ de ces transformations est appelé concentration en CMC.
Que signifie CMC ?
La CMC, ou concentration critique de micellisation , est la concentration à laquelle les micelles commencent à se former suite à l’auto-agrégation des monomères accumulés en agrégats plus grands . Cette formation d’agrégats de molécules s’accompagne également d’une modification de leurs propriétés physiques. Au-dessus de la CMC, un tel groupe de molécules reste en équilibre avec les molécules individuelles, devenant ainsi une forme thermodynamiquement stable. Cet équilibre est un point de transition clé, car il peut se maintenir en continu dans les deux sens. Par exemple, lors de la dilution, les micelles se décomposent à nouveau. En dessous de la concentration de CMC, les molécules de tensioactif se déplacent librement dans la solution, sans structure organisée.
Propriétés physiques des micelles
À mesure que la concentration de tensioactif dans la solution augmente, les changements suivants se produisent :
- Tension superficielle,
- Conductivité électrique,
- Intensité de diffusion de la lumière,
- Viscosité.
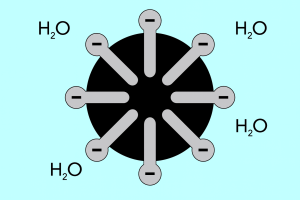
Tête et queue – structure des micelles
La structure des micelles peut être divisée en deux parties principales, qui diffèrent considérablement en termes de polarité et sont appelées :
- Tête hydrophile , qui possède une forte affinité pour l’eau. C’est la partie de la micelle responsable de la tendance des particules à se combiner à l’eau, mais aussi à repousser les graisses.
- La queue hydrophobe , également connue sous le nom de queue lipophile, qui a l’effet inverse : elle attire les molécules vers les graisses et repousse l’eau.
La zone hydrophobe est le plus souvent constituée de chaînes hydrocarbonées, de radicaux :
- alkyle,
- alkylaryle,
- radicaux hydrocarbonés fluorés.
La zone hydrophile est constituée de groupes interagissant fortement avec l’eau, comme les groupes ionogènes. Des groupes non ioniques, comme les groupes éther, peuvent également faire partie de la zone hydrophile des micelles, mais cela nécessite généralement la présence d’un plus grand nombre de groupes polaires dans la molécule.
Le processus de micellisation
Comme la partie non polaire de la substance, par exemple la chaîne alkyle d’une molécule de tensioactif dispersée, présente une grande surface de contact avec l’eau, et que l’interaction entre plusieurs molécules d’eau est bien plus forte que leur interaction avec les groupes –CH₂ présents dans la chaîne, l’entropie du système diminue et les molécules d’eau commencent à s’organiser au niveau de la chaîne alkyle.
Cela provoque un déplacement des chaînes hydrocarbonées de l’intérieur de la phase aqueuse. Plus la concentration de tensioactif augmente, plus le nombre de collisions entre elles augmente. Cela augmente également le risque d’agrégation et d’épaississement des molécules.
La condensation des molécules s’accompagne d’une diminution de l’enthalpie libre. Ceci résulte également de la combinaison de résidus apolaires avec un noyau apolaire à l’état liquide, séparé de la phase aqueuse par des groupes polaires. Une fois la concentration en CMC mentionnée ci-dessus, c’est-à-dire la concentration micellaire critique, atteinte, des amas sphériques s’accumulent, dans lesquels les groupes polaires des particules individuelles sont dirigés vers la phase aqueuse, tandis que les chaînes hydrocarbonées apolaires forment l’intérieur. Les micelles ainsi formées sont appelées micelles normales. Dans les solvants organiques, des micelles inverses peuvent apparaître, dont la partie hydrophobe est située à l’extérieur. 
Types et exemples de tensioactifs
Le type de tensioactifs utilisés pour former des micelles a un impact considérable sur leur structure et leur fonctionnalité. Vous trouverez ci-dessous les types et exemples de tensioactifs les plus courants pour la formation de micelles.
Exemples d’ions tensioactifs
Ions chargés négativement, cations :
- carboxylate,
- sulfate,
- sulfonate,
- phosphate.
Ions chargés positivement, cations :
- ammonium,
- phosphonium.
Types de tensioactifs
- Tensioactifs ioniques
- Anionique, par exemple SDS ou dodécylsulfate de sodium,
- Cationique, par exemple CTAB, ou bromure de cétyl triméthyl ammonium,
- Amphions, c’est-à-dire des ions dits amphiphiles ou bipolaires, qui possèdent à la fois un groupe cationique chargé positivement et un groupe anionique chargé négativement, par exemple la lécithine, c’est-à-dire la phosphatidyloline.
- Tensioactifs non ioniques, par exemple les polyoxyéthylènes.
Activité de surface des tensioactifs et structure micellaire
Ce paramètre, caractéristique des composés tensioactifs, augmente avec le nombre de groupes méthylène présents dans la chaîne hydrocarbonée.
En raison de la structure de la chaîne, les micelles peuvent être divisées en :
- Chaîne unique
- Anionique, par exemple SDS,
- Cationique, par exemple CTAB.
- Double chaîne
- Anionique, par exemple AOT, c’est-à-dire bis(2-éthylhexyl)succinatesulfonate de sodium,
- Cationique, par exemple bromure de dihexadécyldiméthylammonium.
- Moléculaire, par exemple MGDG, c’est-à-dire monogalactosyl diglycéride.

Application de micelles
Les micelles ont un large éventail d’applications, de la cosmétologie à l’industrie pharmaceutique et chimique. Découvrez les principaux domaines d’application de leurs propriétés.
Nettoyage efficace de la peau
Ceci est rendu possible grâce à la présence de particules lipophiles et hydrophiles. Par exemple, dans les démaquillants à base d’eau micellaire, les particules hydrophobes se lient au sébum et aux résidus de maquillage, tandis que les particules hydrophiles attirent la poussière et les impuretés. Il en résulte un double effet nettoyant, permettant un nettoyage efficace et en profondeur, sans dessécher ni irriter la peau.
Les produits micellaires sont même recommandés pour les peaux sensibles grâce à leur action douce. Plus besoin de frotter ni d’appuyer fort avec un coton, et l’action de ces colloïdes est comparable à celle d’un aimant sur les impuretés. Les solutions aqueuses contenant des micelles ne perturbent pas le film hydrolipidique de l’épiderme.
Formulation de cosmétiques micellaires
Un autre avantage des micelles, ces particules très fines, est qu’elles peuvent être utilisées dans de nombreuses formulations. Elles peuvent être utilisées sous leur forme la plus courante – l’eau micellaire – mais aussi dans les crèmes et les lotions. Des formules gel hautement concentrées sont également disponibles, qui ne nécessitent ni serviettes ni cotons : il suffit de les masser et de les rincer à l’eau.
Action en trois étapes des micelles
- Attirer les impuretés grâce aux queues hydrophobes,
- L’encapsulation , qui emprisonne les molécules de graisse et de saleté à l’intérieur des micelles,
- Élimination des impuretés piégées dans les micelles grâce à des têtes hydrophiles restant en contact avec la phase aqueuse.
Autres applications industrielles des micelles
- Cosmétologie , principalement des liquides micellaires et des lotions démaquillantes, mais aussi des shampoings micellaires pour un nettoyage en profondeur du cuir chevelu et des gels douche.
- La pharmacie , par exemple, permet d’augmenter la biodisponibilité des substances actives en introduisant dans l’organisme des médicaments à solubilité limitée sous forme de solutions micellaires non ioniques.
- Produits de nettoyage : le processus de solubilisation mentionné précédemment explique la physicochimie du lavage. Les colloïdes micellaires, sous forme de solutions, entourent la graisse, séparent la saleté et la retirent du tissu. Grâce à l’utilisation de tensioactifs ioniques, les particules de saleté et la surface à laquelle elles adhèrent acquièrent la même charge, ce qui facilite leur séparation.
- Procédés physiques et chimiques : catalyse micellaire, inhibition de réactions chimiques, procédés de flottation et de récupération du pétrole.
- Witek K. Synteza, właściwości powierzchniowe i zastosowanie surfaktantów amfoterycznych, zawierających ugrupowania labilne, Politechnika Wrocławska 2022
- K.Michocka Otrzymywanie i właściwości użytkowe nowych surfaktantów z ugrupowaniem cukrowym, Uniwersytet Ekonomiczny w Poznaniu 2012
- A.Piotrowska-Kirschling, J.Drzeżdżon, L.Chmurzyński, D.Jacewicz Krytyczne stężenie micelarne i metody jego wyznaczania, Wiadomości chemiczne 2018
- https://wydawnictwo.ue.poznan.pl/books/978-83-8211-090-6/sample.pdf
- https://home.agh.edu.pl/~nmos1/FUK/fizykochemia_powierzchni_skany/15/dutkiewicz_15.pdf
- https://phavi.umcs.pl/at/attachments/2018/0608/143246-chemia-koloidow-cwiczenie-1.pdf






























































































































